查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
肝纤维化和肝硬化是全球重大健康问题,目前依旧无法治愈,即使是肝移植也存在较大的风险和局限性,因此迫切需要开发新的治疗策略。近年来,巨噬细胞疗法和CAR-T细胞疗法逐渐崭露头角,前者可归巢至肝脏,调节肝脏免疫微环境并缓解肝纤维化、促进肝再生、改善肝功能;后者可识别并清除表达衰老标志物尿激酶纤溶酶原激活受体(uPAR)的肝星状细胞(HSC)(当发生慢性肝损伤时,HSC会被激活并转变为肌成纤维细胞,同时分泌大量细胞外基质(ECM)促进肝纤维化),进而减轻模型小鼠的肝纤维化。为了进一步开发特异性、疗效更高的细胞疗法,本研究结合两种方法的优势,用特异性CAR对巨噬细胞进行改造,评估其在肝纤维化模型中的有效性和安全性,旨在为肝纤维化的治疗开辟新途径。

2024年1月29日,安徽医科大学第一附属医院王华教授团队在《Journal Of Hepatology》(IF=26.8)上发表题为“Chimeric antigen receptor-modified macrophages ameliorate liver fibrosis in preclinical models”的研究论文。本研究设计出第一代针对uPAR的CAR,并成功构建表达CAR的巨噬细胞(CAR-Ms),通过靶向HSC用以探讨其在改善肝纤维化和肝功能方面的有效性和安全性。为此,作者建立了毒性诱导的肝纤维化、胆汁淤积诱导的肝纤维化以及非酒精性脂肪肝炎(NASH)相关的肝纤维化小鼠模型,将构建好的CAR-Ms经尾静脉注射至模型小鼠体内,结果发现CAR-Ms可特异性归巢至肝脏,调节肝脏免疫微环境,促进中性粒细胞和M2巨噬细胞的浸润,以减轻小鼠的肝纤维化程度和改善肝功能。此外,CAR-Ms能够招募和呈递抗原给T细胞,引起抗纤维化特异性T细胞反应,进而减少肝纤维化。重要的是,CAR-Ms治疗期间对小鼠没有产生副作用。本研究证明了CAR-Ms可作为一种治疗肝纤维化的潜在策略,值得进一步开展临床试验研究。
本研究中,汉恒生物有幸为作者提供了uPAR-CAR腺病毒,以成功构建uPAR CAR-Ms,此外,还提供了转染试剂LipoFiterTM。
下面我们一起来看看作者是如何发掘其中的机制:
1.构建针对uPAR的CAR-Ms并评估其吞噬作用
作者首先通过免疫组化和单细胞转录组分析了肝纤维化患者的组织标本,发现uPAR在肝纤维化和肝硬化的人类和小鼠模型中的表达量均明显增加,提示其或可成为一个潜在的治包含一段针对小鼠uPAR的单链可变片段(scFv),并与小鼠CD3ζ信号结构域连接。将CAR序列构建到腺病毒载体后导入小鼠BMDMs(骨髓源性巨噬细胞)中,经流式细胞术分析和qPCR检测,发现巨噬细胞成功表达了scFv,同时保持了M0状态,没有转变为M1或M2状态,并且能够识别并吞噬uPAR阳性的靶细胞,包括CCl4处理的小鼠原代HSC(图1)。结果表明,CAR-Ms在体外针对uPAR具有靶向吞噬活性。
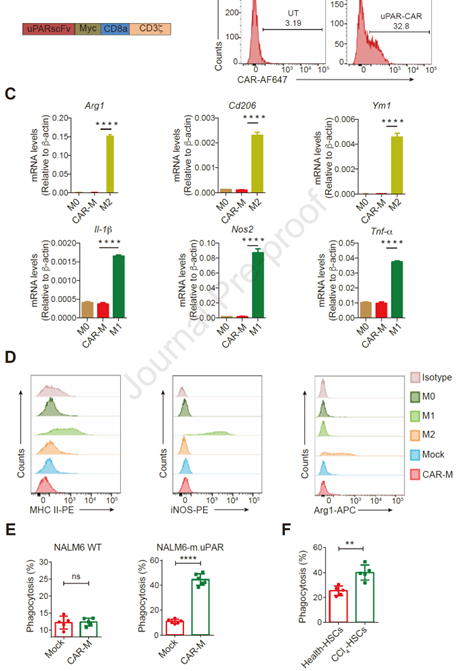
图1. 构建小鼠CAR-Ms并评估其吞噬作用
2. CAR-Ms可减轻毒素、胆汁淤积和NASH诱导的纤维化
接着,作者探讨了CAR-Ms在几种不同肝纤维化小鼠模型中的抗纤维化效果,其中包括重复注射CCl4毒素引起的纤维化、DDC饮食引起的胆汁淤积性纤维化,以及高脂/高胆固醇/高果糖(HFCF)饮食诱导的NASH相关的肝纤维化。通过生理生化相关指标及组织切片分析发现,相较于PBS处理组和BMDMs治疗组,CAR-Ms治疗组中ECM沉积、丙氨酸氨基转移酶(ALT)水平、羟脯氨酸水平和肝纤维化标志物表达均显著减少,胆红素活性增强(图2)。这些结果表明,CAR-Ms能够减轻肝纤维化水平,改善肝功能。
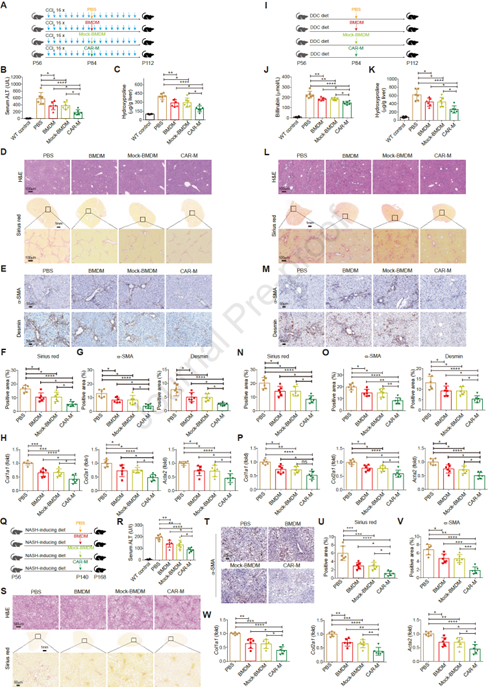
图2. CAR-Ms可减轻毒素、胆汁淤积和NASH诱导的肝纤维化
3. CAR-Ms可减轻肝硬化小鼠模型的晚期纤维化
为进一步验证CAR-Ms能否抑制小鼠肝纤维化,作者构建了一个持续12周、每周两次注射CCl4的小鼠模型(模拟晚期肝纤维化),其中第16次注射CCl4后的24小时内给小鼠注射了CAR-Ms(图3A)。同样与PBS组、BMDMs治疗组相比,接受CAR-Ms治疗的小鼠血清中ALT水平显著下降(图3B),表明肝损伤症状得到改善。免疫组化及qPCR检测肝损伤和肝纤维化标志表达水平结果均与之一致(图3C-H)。表明CAR-Ms能够显著改善晚期肝纤维化,提示靶向uPAR的CAR-Ms可能是治疗肝硬化的潜在疗法。
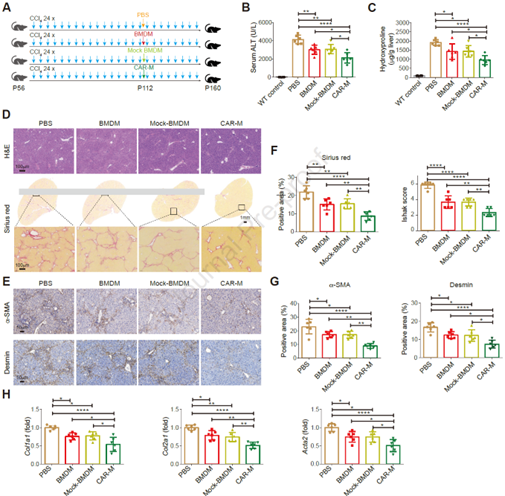
图3. CAR-Ms可减轻肝硬化小鼠的肝损伤
4. CAR-Ms可定位于肝脏并发挥功能
作者接着分析了CAR-Ms经尾静脉注射后在体内的转运和分布情况。在CCl4诱导的肝纤维化小鼠模型中,通过分子成像显示,CAR-Ms在注射5天后特异性地聚集到了肝脏,而在其它脏器中没有分布(图4 A-C)。重要的是,免疫组化和TUNEL染色结果显示,CAR-Ms治疗后,纤维化小鼠的肝脏中uPAR阳性区域显著减少,HSC凋亡增加(图4 D-G)。这些结果表明,CAR-Ms可在体内转运至肝脏并消除靶细胞,从而减轻肝纤维化。
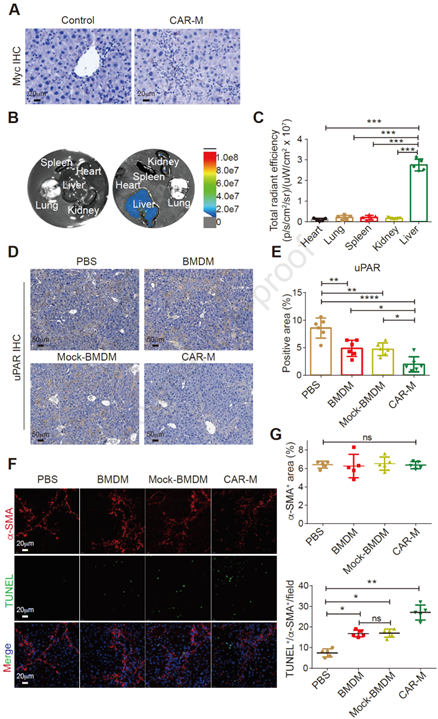
图4. CAR-Ms归巢至肝脏并发挥作用
5. CAR-Ms改善纤维化小鼠的肝功能
随后,作者进一步探讨CAR-Ms是否能恢复纤维化小鼠的肝功能。同样在CCl4诱导的肝纤维化小鼠模型中,与对照组相比,CAR-Ms治疗组的肝细胞生长因子(HGF)表达水平、血清白蛋白水平显著增加,增殖标志物Ki67表达增加(图5)。结果表明,CAR-Ms的治疗促进了纤维化小鼠的肝细胞增殖和肝功能恢复。
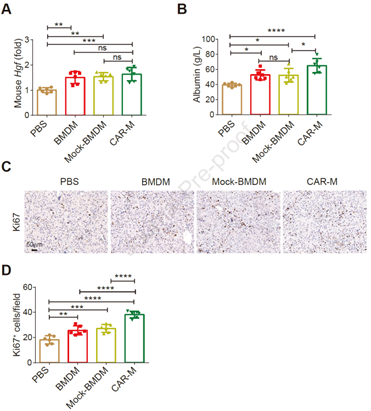
图5. CAR-Ms改善了纤维化小鼠的肝功能
6. CAR-Ms促进血液循环中巨噬细胞和中性粒细胞募集到肝脏
据研究发现,巨噬细胞疗法可通过募集内源性巨噬细胞和中性粒细胞来缓解肝纤维化[1,2]。于是作者通过流式细胞分选(FACS)分析CAR-Ms治疗后肝脏中免疫细胞的组成,结果发现注射7天后内源性中性粒细胞浸润水平达到高峰,且与qPCR检测中性粒细胞趋化因子Cxcl1和Cxcl2的表达一致(图6 A-E)。其中募集的中性粒细胞会产生MMP-9以减少肌成纤维细胞数量并抑制实验性肝损伤期间的纤维化。作者在CAR-Ms治疗的纤维化小鼠的肝脏中也观察到了MMP-2/-9/-13的表达显著上调(图6 F)。此外,CAR-Ms治疗后可抑制实验中期巨噬细胞的浸润,并使其向抗炎的M2巨噬细胞转变。这些结果表明,CAR-Ms可促进中性粒细胞和M2巨噬细胞在肝脏中浸润,共同改善肝纤维化。
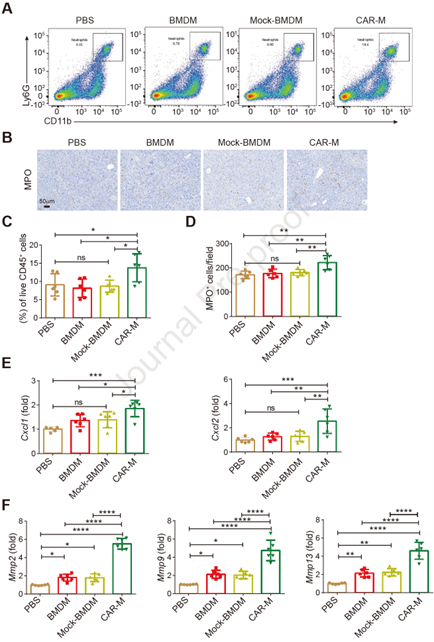
图6. CAR-Ms影响肝脏中的中性粒细胞浸润
7. CAR-Ms引起了一种针对肝纤维化的特异性T细胞反应
巨噬细胞除了吞噬的另一重要作用是呈递抗原,因此作者接着评估了CAR-Ms将抗原呈递给T细胞的能力,以验证其是否可以引起具有抗原特异性的细胞毒性T细胞(CD8+T细胞)反应。在接受CAR-Ms治疗的纤维化小鼠中,观察到肝内CD4+T和CD8+T细胞增加,纤维化情况得到改善(图7 A-D)。通过提取原代CD8+T细胞和HSC进行杀伤实验。结果显示,与对照组相比,CAR-Ms治疗小鼠的肝内CD8+T细胞对HSC的杀伤力更强(图7 E)。进一步使用CD8抗体消耗小鼠体内的CD8+T细胞,以此削弱CAR-Ms在体内的治疗作用,结果表现为纤维化标志物(α-SMA、中间丝状体蛋白)、肝内羟脯氨酸水平均增加(图7 F-I)。以上结果表明,CAR-Ms可交叉呈递抗原同时激活T细胞反应,不仅可以直接减轻纤维化,还可以调节肝脏免疫微环境并产生疫苗效果。
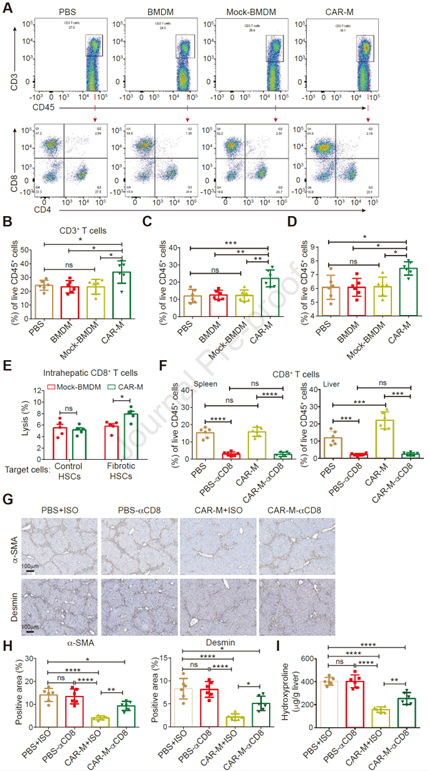
图7. CAR-Ms向T细胞呈递抗原,并激活T细胞
8. CAR-Ms治疗后进行单细胞测序分析
为了更深入了解CAR-Ms诱导的细胞类型的变化,作者通过FACS技术分选出不同处理组的纤维化小鼠肝脏中的所有白细胞(CD45+),随后进行单细胞RNA测序分析(图8 A)。结果发现其中包含Ly6chi巨噬细胞、Ly6clo巨噬细胞、pDC、cDC2s、cDC1s、ILC1s、中性粒细胞、循环T细胞、NK细胞、B细胞和T细胞(图8 B-F)。经每种细胞谱系的标志基因分析显示,CAR-Ms治疗组纤维化小鼠中泛巨噬细胞标志物减少,M2巨噬细胞比例显著增加,M1巨噬细胞比例减少(图8 G-K),这与TGF-β和炎症反应基因表达显著降低的结果一致(图8 L)。接着作者分析了T细胞亚群,发现循环T细胞几乎只存在于接受CAR-Ms治疗的小鼠中,并表现为细胞周期标志物和增殖标志物的高表达,且细胞毒性CD8+T细胞显著增加(图8 C-F)。综上结果表明,CAR-Ms治疗小鼠体内的循环T细胞发生了显著的变化,主要分化为细胞毒性CD8+T细胞。
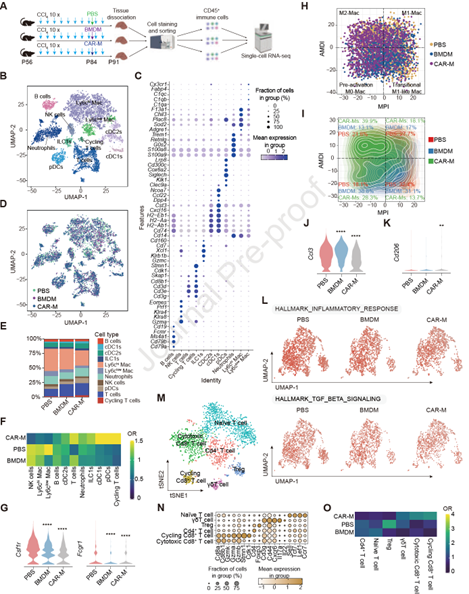
图8. 单细胞RNA测序证实CAR-Ms治疗可调节肝脏免疫微环境
综上所述,本研究首先建立了CCl4诱导的毒性纤维化、DDC饮食诱导的胆汁淤积纤维化和HFCF饮食诱导的NASH纤维化小鼠模型,并将CAR-Ms经尾静脉注射至纤维化小鼠中,随后检测到CAR-Ms被招募到受损肝脏中,并可以减轻小鼠模型中的肝纤维化和肝硬化,恢复肝功能的同时还表现出疫苗的效果。本研究证明了利用CAR对巨噬细胞进行改造可能成为治疗肝纤维化的有效方法。
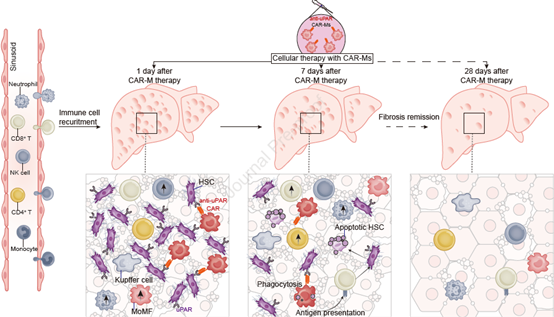
图形摘要. CAR-Ms可减轻肝纤维化并改善肝功能
参考文献
[1] Ma PF, Gao CC, Yi J, et al. Cytotherapy with M1-polarized macrophages ameliorates liver fibrosis by modulating immune microenvironment in mice. J Hepatol. 2017;67(4):770-779.
[2] Thomas JA, Pope C, Wojtacha D, et al. Macrophage therapy for murine liver fibrosis recruits host effector cells improving fibrosis, regeneration, and function. Hepatology. 2011;53(6):2003-2015.

查看更多

查看更多

查看更多

联系我们

返回顶部