查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
2024年9月,中山大学王菲、暨南大学肖佳、安徽医科大学王华团队合作在《Cell Metabolism》(IF=27.7)上发表了题为“Myeloid beta-arrestin 2 depletion attenuates metabolic dysfunction-associated steatohepatitis via the metabolic reprogramming of macrophages(髓系β-arrestin 2缺失通过巨噬细胞的代谢重编程减轻代谢功能障碍相关的脂肪性肝炎)”的研究论文。研究中使用了汉恒生物提供的AAV8-TBG-miR30-shArrb2来敲低肝细胞中的Arrb2,研究其是否可以防止饮食诱导的代谢功能障碍相关性脂肪性肝炎(MASH)。

代谢功能障碍相关性脂肪性肝病(MASLD)是一个全球性的健康问题,影响着全球约25%的人口。MASH是代谢功能障碍相关性脂肪肝(MASL)的严重形式,其特征是持续的肝脏损伤、炎症和纤维化。先天免疫系统的失调在MASH进展中起着关键作用。肝脏巨噬细胞是肝脏中最丰富的先天免疫细胞,包括肝驻留的库普弗细胞(KCs)和单核细胞来源的巨噬细胞(MDMs),脂肪酸和脂质积累引起的肝细胞死亡能够促进KCs的激活和细胞因子的释放,随后招募MDMs进入肝脏。此外,活化的肝巨噬细胞可分泌细胞因子加剧肝脏炎症损伤,并能激活肝星状细胞(HSCs),进而促进纤维化和肝硬化的发生。β-arrestin 2(由Arrb2基因编码)是一种多功能适配蛋白,在代谢调节中发挥作用。然而,β-arrestin 2是否调节免疫细胞代谢以及MASLD/MASH过程仍有待阐明。
本研究中,作者使用了全身Arrb2-KO小鼠、髓系特异性Arrb2-KO小鼠和三种动物饮食模型来阐明β-arrestin 2在MASLD/MASH中的作用,并揭示了髓系β-arrestin 2在MASH中的作用机制,为预防和干预MASLD/MASH进展提供了新思路。
1. 全身β-arrestin 2缺失减轻饮食诱导的MASH
作者首先喂食野生型(WT)小鼠和Arrb2-KO小鼠高脂饮食(HFD)或正常对照饮食(NCD)24周,以确认β-arrestin 2在肝脏脂肪变性发展中的作用,结果显示,相比WT组,HFD喂食的Arrb2-KO小鼠体重增加减少,白色脂肪组织(WAT)显著减少,肝脏重量和脂质含量相对较低,肝脏脂肪变性症状较轻(图1A-F)。同时,通过检测高脂高胆固醇(HFHC)或甲硫氨酸胆碱缺乏(MCD)和HFD饮食的Arrb2-KO和WT小鼠血清中丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平,促炎细胞因子、趋化因子和抗炎因子mRNA水平(图1I),肝脏巨噬细胞(F4/80+细胞)浸润情况(图1J),肝脏纤维化情况(图1K)等指标,结果表明相同饮食模型的Arrb2-KO小鼠较WT小鼠表现出更低的肝脏损伤。说明全身Arrb2缺失可减轻饮食诱导的肝脏脂肪变性、炎症和纤维化。
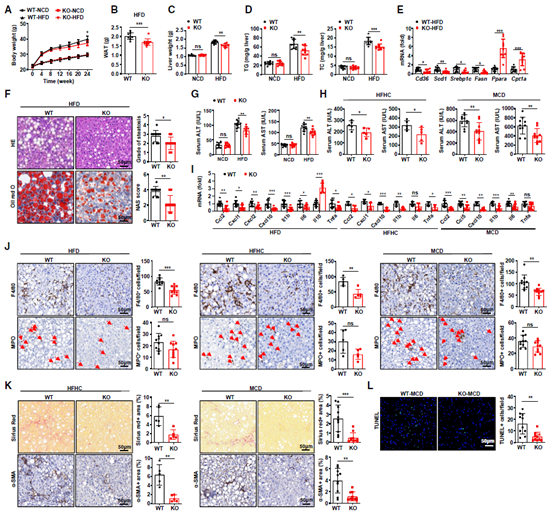
图1 小鼠全身β-arrestin 2缺失减轻饮食诱导的MASH
2.髓系β-arrestin 2的缺失可以防止饮食诱导的MASH
先前的研究表明,肝细胞中的β-arrestin 2在酒精性肝病(ALD)模型中诱导脂质积累和代谢紊乱,由此作者推测肝细胞中的β-arrestin 2可能在MASLD进展中同样发挥作用。然而,在肝细胞Arrb2敲低小鼠和WT小鼠中,MCD饮食诱导的肝脂肪变性、炎症或纤维化没有差异(图2C-H)。同样,棕榈酸(PA)和油酸(OA)诱导的脂质积累对缺乏β-arrestin 2的原代肝细胞中没有影响(图2I-M)。这表明肝细胞β-arrestin 2沉默对MASLD的发展没有显著影响。
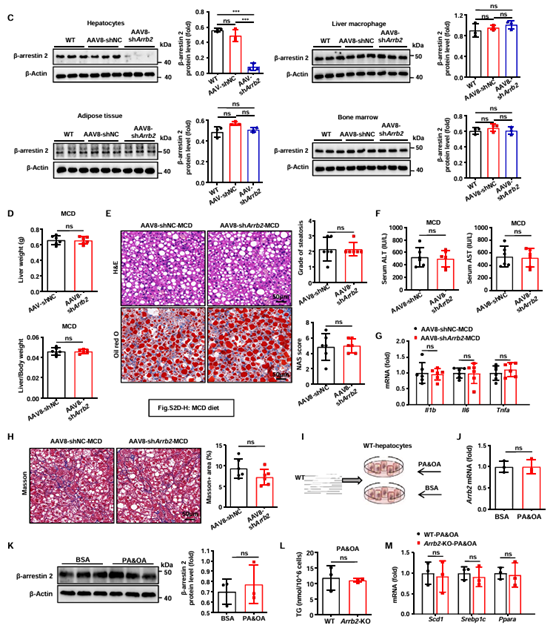
图2 肝细胞β-arrestin 2缺失不能改善饮食导致的肝脂肪变性、炎症和纤维化
基于以上实验结果,作者先评估了β-arrestin 2在不同细胞类型中的丰度,发现Arrb2在单核细胞、库普弗细胞(KCs) 和巨噬细胞中高表达,但在人细胞类型的肝细胞中低表达(图3A-B)。MASH患者和HFD、HFHC或MCD饮食的小鼠模型评估结果显示,β-arrestin 2在肝巨噬细胞中高表达(图3C-H),此外,HFD喂养的Arrb2-KO小鼠表现出较低的肝脏MDM浸润(图3I)。这些结果表明巨噬细胞而非肝细胞的β-arrestin 2可能参与了MASH的发病机制。
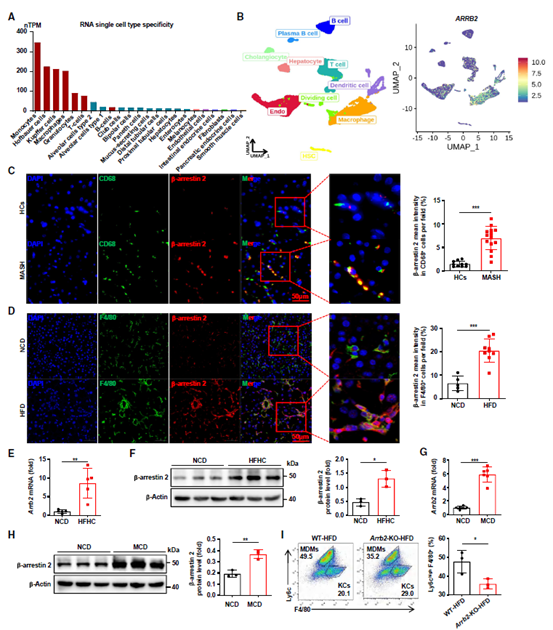
图3 β-arrestin 2在MASLD患者和小鼠肝巨噬细胞中表达量较高
为了验证这一猜想,作者构建了骨髓特异性Arrb2敲除小鼠(Arrb2f/fLyz2Cre)和对照小鼠(Arrb2f/f),并喂食HFHC或MCD饮食。与之前在Arrb2-KO小鼠中观察到的结果相似,Arrb2f/fLyz2Cre小鼠的体重比Arrb2f/f小鼠略低,WAT脂肪细胞面积小(图4A-B),MASH表型有所改善(图4C-J)。同时,作者还观察到Arrb2f/fLyz2Cre小鼠的肝巨噬细胞数量低于Arrb2f/f小鼠(图4K)。这些数据证实髓系而非肝细胞的β-arrestin 2缺失可以防止饮食诱导的MASH。
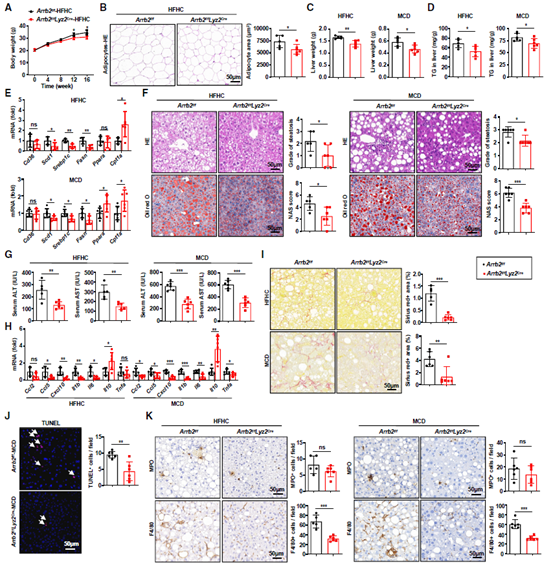
图4 髓系β-arrestin 2缺失可以防止饮食诱导的MASH
3.髓系β-arrestin 2缺失可降低巨噬细胞的M1极化
巨噬细胞的激活会促进肝脏炎症的启动和进展,使其从单纯脂肪变性转变为MASH。与该理论相符,在前面的实验中作者观察到Arrb2-KO小鼠和Arrb2f/fLyz2Cre小鼠表现出对饮食诱导的MASH的抵抗,肝巨噬细胞含量显著降低。于是,作者进一步探究了β-arrestin 2与巨噬细胞表型之间的功能联系。作者从MCD喂养的WT和Arrb2-KO小鼠中分离肝巨噬细胞进行Illumina Hiseq测序,发现Arrb2- KO小鼠的肝巨噬细胞中有一组炎性白细胞介素(IL)基因和多种M1巨噬细胞促炎基因下调(图5A-B)。通过分析KCs和MDMs中M1和M2巨噬细胞表面标记物,结果显示MCD饮食喂养的Arrb2-KO小鼠中M1巨噬细胞标志物(Il1b、Nos2和Cd86)mRNA表达相比WT小鼠有所下降,表明肝脏MDMs的M1极化降低(图5C-D)。在HFHC喂养的Arrb2f/fLyz2Cre小鼠中也观察到了类似的结果(图5E-F)。此外,作者还从Arrb2-KO和WT小鼠中分离了原代骨髓源性巨噬细胞(BMDMs)和小鼠腹膜巨噬细胞(MPMs)分析,发现巨噬细胞中Arrb2的缺失降低了BMDMs和MPMs M1极化的能力(图5G-J)。综上,这些结果表明髓系β-arrestin 2缺失通过影响M1分化来减轻巨噬细胞的促炎反应。
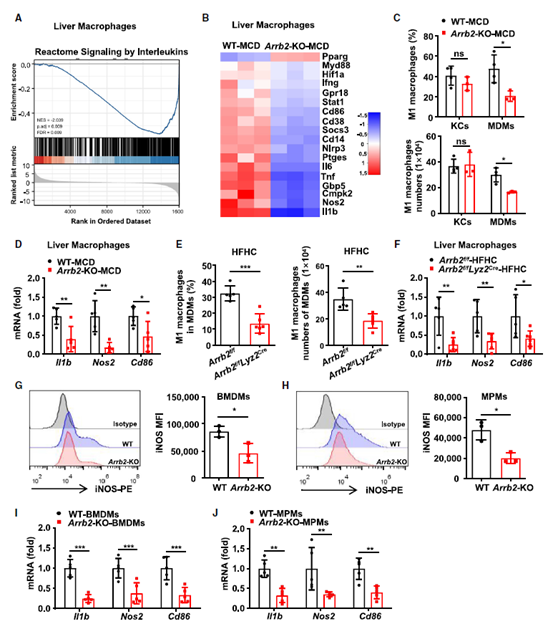
图5 巨噬细胞中β-arrestin 2缺失可阻止M1极化
4.β-arrestin 2介导巨噬细胞的代谢重编程
为了进一步探究β-arrestin 2在巨噬细胞极化中的分子机制,作者对MCD喂养的Arrb2-KO和WT小鼠的肝巨噬细胞mRNA测序进行了KEGG富集分析,结果显示代谢途径相关基因的富集程度最高(图6A)。代谢重编程是调控巨噬细胞极化的关键因素。 GSEA进一步显示,与WT小鼠相比,MCD喂养的Arrb2-KO小鼠的肝巨噬细胞中线粒体氧化磷酸化(OXPHOS)途径基因高度富集(图6B)。此外,与WT小鼠相比,MCD喂养的Arrb2-KO小鼠的肝巨噬细胞中,代表OXPHOS的耗氧率(OCR)显著增加(图6C),而代表糖酵解、葡萄糖积累和乳酸生成的细胞外酸化率(ECAR)显著降低(图6D-F)。以上数据表明β-arrestin 2可减弱OXPHOS,增强糖酵解,从而促进巨噬细胞的M1型极化。
接着,作者测定了与糖酵解代谢和线粒体三羧酸(TCA)循环相关的酶活性。与相同饮食的对照组小鼠相比,MCD喂养的Arrb2-KO或HFHC喂养的Arrb2f/fLyz2Cre小鼠的肝巨噬细胞中的琥珀酸脱氢酶(SDH)活性显著下降(图6G-H)。SDH活性与炎症反应有关,SDH促进线粒体氧化琥珀酸盐,导致线粒体活性氧(mtROS)的产生,mtROS作为线粒体的氧化还原信号,稳定HIF-1,驱动IL-1b的产生并促进炎症。MCD喂养的Arrb2-KO小鼠肝巨噬细胞中表现出较低水平的mtROS(图6I)。另外,与相同饮食喂养的对照组小鼠相比,MCD喂养的Arrb2-KO或HFHC喂养的Arrb2f/f Lyz2Cre小鼠的肝巨噬细胞中HIF-1a和IL-1b蛋白水平下调(图6J-K)。以上结果均与预期相符,表明β-arrestin 2介导巨噬细胞在MASH进展过程中的代谢重编程,从而增强肝巨噬细胞的炎症反应。
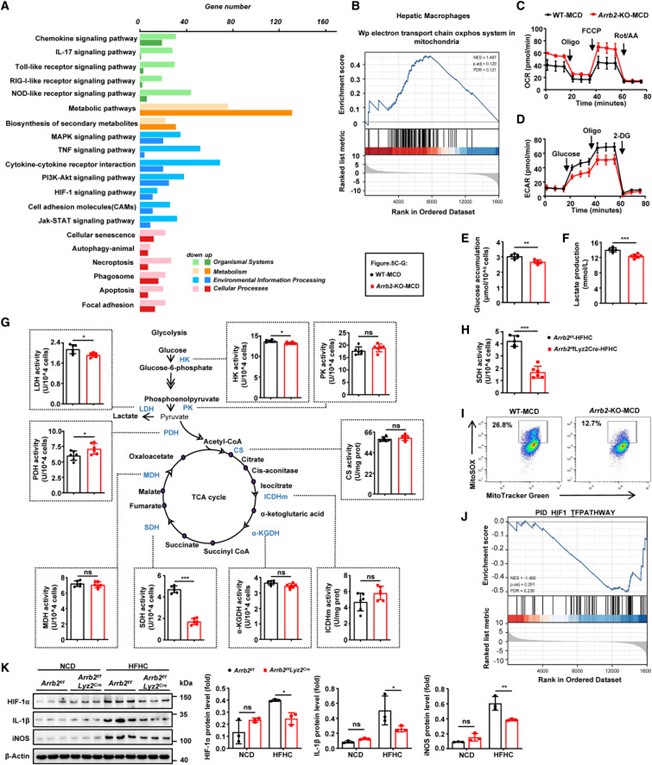
图6 β-arrestin 2介导巨噬细胞的代谢重编程
5.β-arrestin 2通过抑制IRG1表达进而减少炎性巨噬细胞衣康酸的产生
随后,作者进一步探究β-arrestin 2介导巨噬细胞代谢重编程的分子机制。通过分析前面的实验结果,作者认为β-arrestin 2与SDH存在相互作用,而免疫共沉淀实验结果显示β-arrestin 2不直接调节SDH活性。通过检测MCD喂养的Arrb2-KO或HFHC喂养的Arrb2f/ flyz2Cre小鼠的肝巨噬细胞,发现与相同饮食喂养的对照组小鼠相比,衣康酸和琥珀酸水平升高,而TCA循环的其他代谢物没有显著差异(图7A)。衣康酸是一种内源性SDH抑制剂,是炎性巨噬细胞中最丰富的抗炎代谢物,可导致琥珀酸积累,而IRG1酶可在活化的巨噬细胞中转化柠檬酸产生衣康酸。因此,作者检测了肝巨噬细胞中IRG1的水平。正如预期的那样,与相同饮食喂养的对照组小鼠相比,HFHC饮食喂养的Arrb2f/fLyz2Cre或MCD饮食喂养的Arrb2-KO小鼠的肝巨噬细胞中IRG1的表达明显更高(图7B)。在LPS/ IFN -γ处理的Arrb2-KO BMDM中也可以观察到类似的结果(图7C),并且敲低细胞中的IRG1基因可逆转表型,表现为衣康酸水平和耗氧率(OCR)降低,SDH活性、mtROS分泌、ECAR和HIF-1α-IL-1β轴的表达增加(图7D-6G),最终导致M1极化显著增加(图7H)。
此外,作者敲除了Arrb2-KO小鼠的IRG1基因(Arrb2-Irg1-DKO),并用HFHC喂养这些小鼠。IRG1的缺失降低了HFHC喂养的Arrb2-KO小鼠肝巨噬细胞中衣康酸水平,同时增加了SDH活性、mtROS和M1极化(图7I - 6L)。IRG1缺失抵消了在Arrb2-KO小鼠中观察到的保护性表型,Arrb2-Irg1-DKO小鼠发生了严重的肝脏脂肪变性、损伤和纤维化(图7M和6N)。
β-arrestin 2抑制IRG1的机制仍需阐明。作者观察到MCD喂养的Arrb2-KO小鼠肝巨噬细胞中IRG1蛋白水平升高,但mRNA水平与WT小鼠相当(图7O),用真核生物翻译抑制剂环己亚胺(CHX)处理肝巨噬细胞后,观察到β-arrestin 2的缺失延长了IRG1蛋白的半衰期(图7P)。因此,作者认为β-arrestin 2通过蛋白降解调节IRG1水平。先前有研究报道β-arrestin 2可启动E3泛素连接酶的募集,从而促进β-arrestin 2结合底物的泛素化。通过免疫共沉淀实验作者发现WT小鼠分离的肝巨噬细胞中β-arrestin 2与IRG1相互作用(图7Q)。与WT小鼠相比,MCD饮食的Arrb2-KO小鼠分离的肝巨噬细胞中内源性IRG1的泛素化降低(图7R)。综上所述,β-arrestin 2通过促进IRG1泛素化降低其表达水平,进而增强SDH活性及其随后的炎症反应来减少炎性巨噬细胞中衣康酸盐的产生。
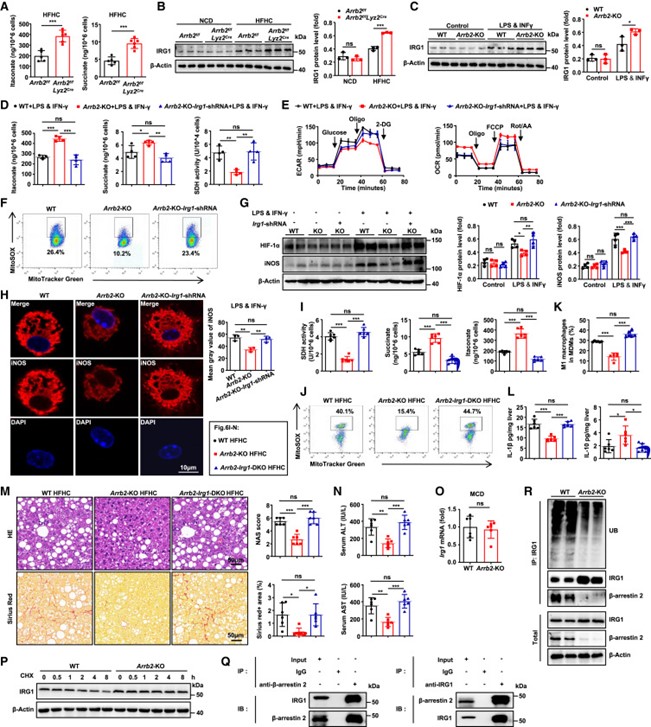
图7 β-arrestin 2缺失通过抑制IRG1表达进而减少炎性巨噬细胞衣康酸的产生
6. β-arrestin 2介导hMDMs的代谢重编程,并在MASLD患者的循环单核细胞中升高
以上实验揭示了β-arrestin 2介导MASH小鼠肝巨噬细胞代谢重编程的机制,而其在人巨噬细胞中介导的代谢途径仍需验证。作者从健康供体(HC)中分离循环单核细胞,然后利用重组人巨噬细胞集落刺激因子(M-CSF)使之在体外进一步分化为巨噬细胞。结果显示,敲低β-arrestin 2导致LPS/ IFN -γ处理的人MDMs(hMDMs)中IRG1表达和衣康酸产生增加,抑制SDH酶活性,减少炎症细胞因子分泌,减少M1型极化(图8A-7G),与小鼠实验数据一致。
接下来,作者检测了MASLD和肝细胞癌(HCC)患者循环单核细胞中Arrb2 mRNA的水平,MASLD患者循环单核细胞中Arrb2 mRNA水平明显高于HCC患者(图8H和7I)。此外,在MASLD患者中,Arrb2 mRNA水平与肝脂肪变性程度、血清ALT和AST呈正相关(图8J和7K)。在MASLD患者中,Arrb2水平与中性粒细胞和单核细胞数量呈正相关,而与淋巴细胞、嗜酸性粒细胞和嗜碱性粒细胞数量无关,其中与单核细胞数量的相关性最为显著(图8L)。此外,MASLD患者循环单核细胞中的Arrb2 mRNA水平与M1巨噬细胞标志物(Il1b、Nos2)mRNA水平呈强正相关(图8M和7N),而β-arrestin 2蛋白水平与IRG1蛋白水平呈负相关(图8O)。上述结果均与小鼠实验数据相符,β-arrestin 2介导hMDMs的代谢重编程,并在MASLD患者的循环单核细胞中升高。
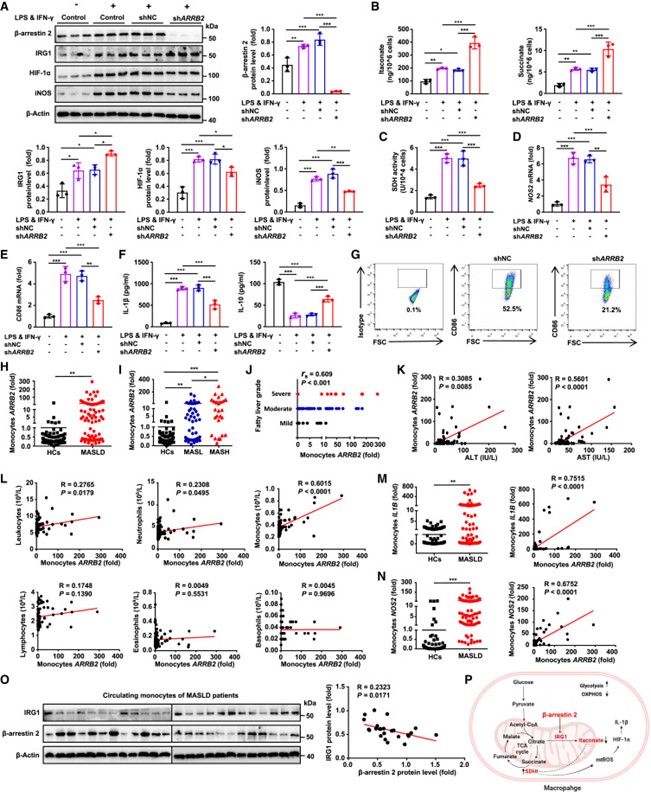
图8 β-arrestin 2介导hMDMs的代谢重编程,并在MASLD患者的循环单核细胞中升高
综上所述,本研究表明髓系β-arrestin 2是维持小鼠肝巨噬细胞的促炎表型和促进MASH进展的关键蛋白,并揭示了其诱导巨噬细胞代谢重编程的机制,该研究结果为开发MASLD/MASH新的诊断标志物和治疗方法提供了理论基础。

查看更多

查看更多

查看更多

联系我们

返回顶部