查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
实时荧光定量PCR (Quantitative Real-time PCR ,RT-qPCR) 是一种研究基因表达极为准确和灵敏的方法。在外源基因导入到靶细胞后,如何确定外源基因在靶细胞的表达情况呢?WB和RT-qPCR检测是非常好的选择。在前两期的干货中我们已经介绍了载体构建和质粒转染的基本操作,本期小恒将向大家详细介绍如何用RT-qPCR检测目的基因的表达水平。

RT-qPCR是一种对特定DNA进行定量分析的方法,其原理是:提取组织或细胞中的总RNA,以其中的mRNA作为模板,采用Oligo(dT)或随机引物利用逆转录酶反转录成cDNA。再以cDNA为模板进行荧光定量PCR,在PCR扩增过程中,通过收集荧光信号,对PCR进程进行实时检测。在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系,以此对模板进行定量。
在实时PCR扩增过程中,荧光信号被收集,转化为成为扩增和熔解曲线。那么首先我们来看几个基本概念:基线,荧光阈值和Ct值。
基线(baseline):是指在PCR扩增反应的最初数个循环里,荧光信号变化不大,接近一条直线,这样的直线即是基线。一般来讲,第3-15个循环的荧光值就是基线。
阈值(threshold):阈值一般是基线的标准偏差的10倍,在实际操作中也可以手动调节,位于指数期就可以。
Ct 值(Ct value):Ct值就是荧光值达到阈值时候的PCR循环次数,跟初始模板的量呈反比。
下面我们从荧光标记方法、详细实验步骤和常见问题分析三个方面来详细讲解RT-qPCR。
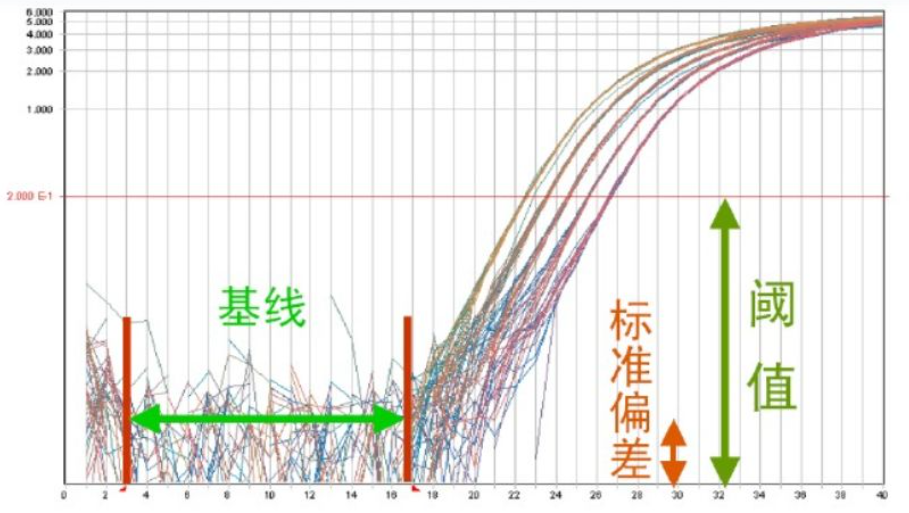
图1.基线、标准偏差和荧光阈值示意图
一、荧光标记方法
RT-qPCR是通过检测反应体系中的荧光强度来检测PCR扩增产物的,其荧光标记方法分为两种:荧光染料嵌合法和荧光探针法。
1.荧光染料嵌合法
荧光染料嵌合法即应用一种带有荧光的、非特异的DNA结合染料检测PCR过程中积累的扩增产物。常用SYBR Green I染料,该染料在游离状态下几乎不会产生荧光,可以非特异地结合在双链DNA的小沟区域,而不与单链结合。扩增的起始阶段,经过热变性双链DNA发生解链变成单链,染料结合不上去,没有荧光信号。随着反应的进行,有双链形成之后,染料就会与之结合,每形成一个DNA双链,就有一定数量的染料结合上去,产生较强的荧光信号,且信号强度与PCR产生的DNA总量成正比,所以荧光信号的强度能反映出体系中双链DNA的浓度。
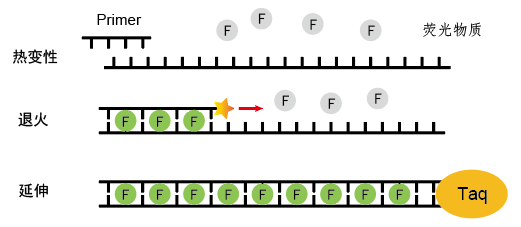
图2.荧光染料嵌合法原理
染料法操作简单、灵敏度高且成本较低,被广泛地应用于科研中对目的基因定量分析和基因表达量的研究。但是SYBR Green I是一种非特异性荧光标记,如果反应体系中具有非特异性扩增和引物二聚体,也会被检测到荧光信号,从而对检测结果产生影响。实验中我们通常需要设计特异性引物,来防止产生非特异性扩增。
那么在实验中如何判断是否有非特异性扩增呢?这里要引入一个概念——熔解曲线。
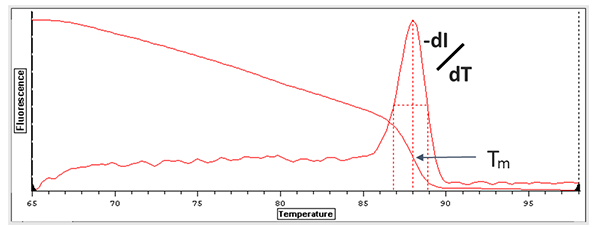
图3.溶解曲线和溶解温度示意图
当PCR循环反应完成之后,系统会测定熔解曲线,反应体系从60℃加热到90℃,然后每隔一定时间测定荧光强度,随着温度升高,dsDNA双链解开,SYBR Green I染料脱落,荧光值逐渐下降,就形成了一个温度和荧光强度的曲线。当加热到一定温度时,曲线会陡降,这个温度就是Tm值。我们将荧光强度对温度的变化求导,就得到了我们常见的带峰的熔解曲线。每一个峰就代表一种特异性产物,所以通过峰的形状和多少就可以判断体系中是否存在引物二聚体和非特异性结合。并且可以判断引物二聚体和非特异性结合是否会影响实验结果。
当熔解曲线为单峰,认为没有非特异性荧光产物的存在,这样可以得到准确的定量结果。如果体系中存在双峰,并且杂峰的高度大于主峰20%,就认为体系中存在比较严重的非特异性荧光产物和引物二聚体,这样的定量结果就是不准确的,这时候就需要重新设计引物。
2.荧光探针法
TaqMan探针法则是应用一个或多个荧光标记的寡核苷酸探针检测PCR扩增产物:依赖荧光能量共振传递(FRET)检测特异性扩增产物。TaqMan探针是一段长约18-24nt的核苷酸序列,它的5’端连接有一个荧光报告基团(F),3’端连接有一个淬灭基团(Q)。
在非杂交状态下,荧光基团与淬灭基团距离较近,当受到照射时,荧光报告基团通过FRET将能量转移到邻近的淬灭基团上,从而抑制荧光报告基团发射出荧光信号。进行PCR时,TaqMan探针可特异地复性杂交到 PCR 产物上。Taq 酶在链延伸过程中遇到与模板结合的 TaqMan探针,其 5'→3'外切酶活性将探针降解,使荧光报告基团与淬灭基团分开,破坏了 FRET,从而产生荧光信号,信号强度与PCR过程中扩增得到的靶DNA产物量成正比。因为只有靶序列与探针互补时荧光信号才会增加,所以不会检测到非特异扩增。
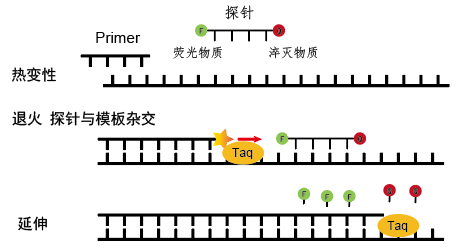
图4.荧光探针法原理
常用的淬灭基团有DABCYL、TAMRA和BHQ,而常用的报告基团有很多,如6-FAM、CY3、TET等,淬灭基团必须与荧光报告基团有光谱重叠,实验中需要注意基团的选择。TaqMan最常用的荧光-淬灭剂组合是:6-FAM或TET作为5'端报告基团,TAMRA作为 3'端淬灭基团。
不同的荧光报告基团检测通道不同,因此可以通过不同通道的报告基团实现多重PCR,即在同一个反应体系中检测多个基因。而染料不能区分不同基因产物的荧光信号,因此一次只能检测一个基因。我们在实验中到底选择哪种方法呢?如果用于区别同源性高的序列,以及进行SNP分型解析等多重PCR检测,那么就只能用荧光探针法。而进行除此之外的RT-qPCR实验,都可以使用荧光染料法。
表1.DNA结合染料法和TaqMan探针法对比
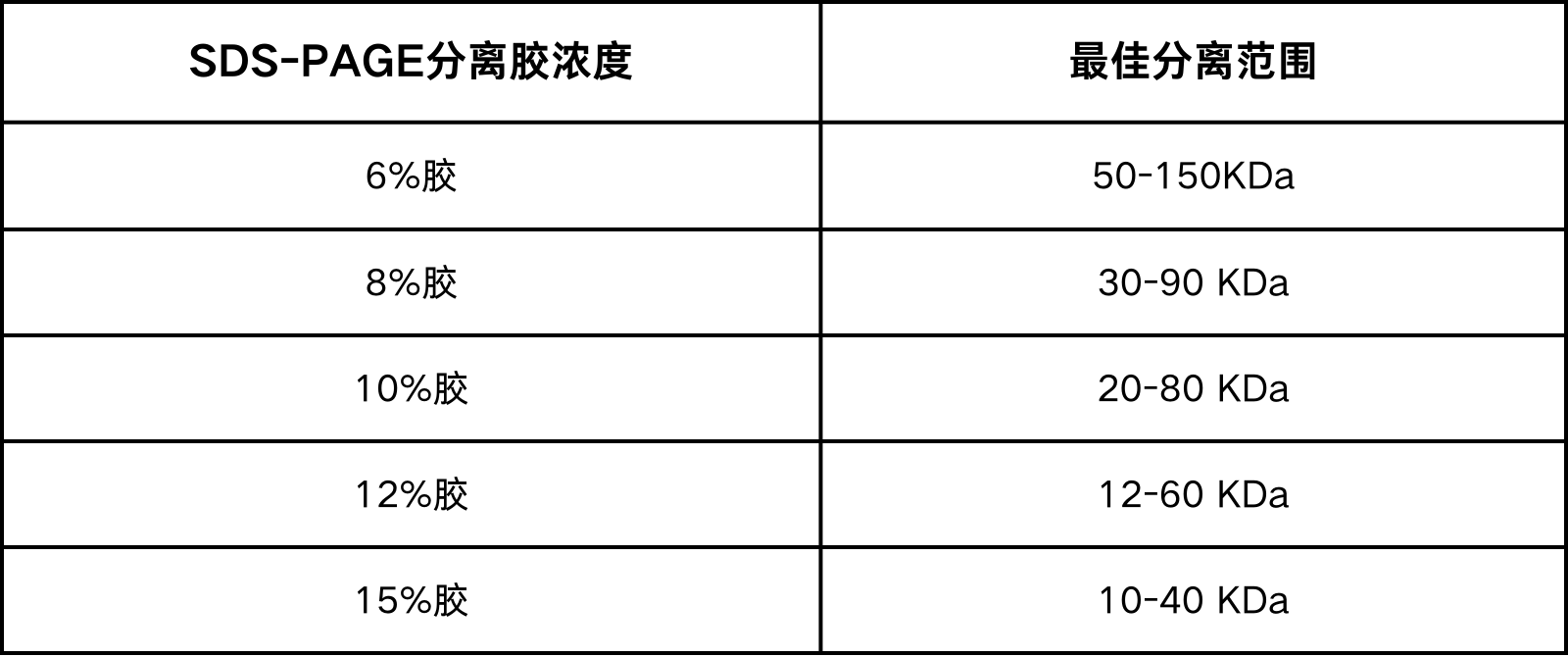
二、实验步骤
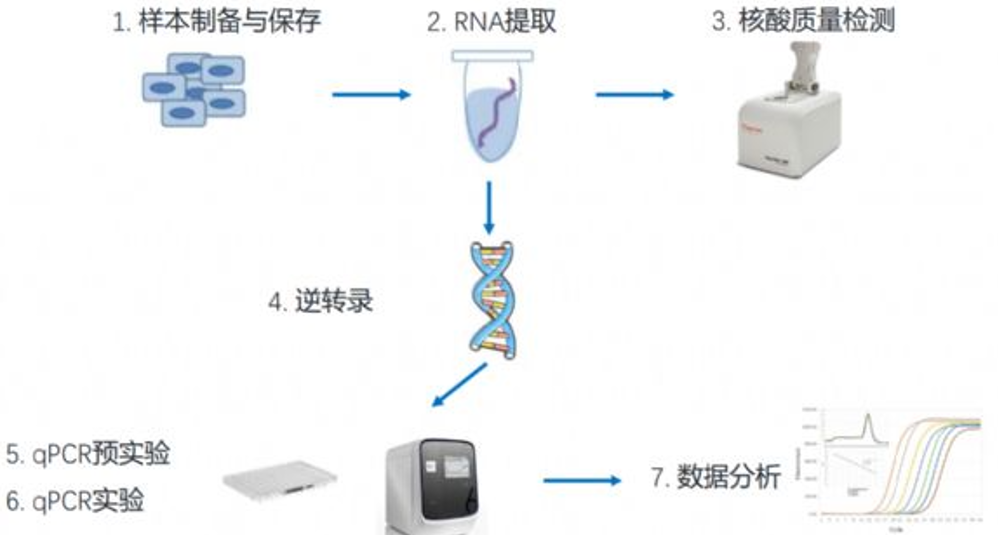
图5.RT-qPCR实验步骤示意图,图片来源:bing.com
1.设计引物
RT-qPCR的第一步是对靶基因设计特异性的引物,引物设计的好坏,关乎着扩增效率的高低、产物特异性的与否,所以引物设计是实验成功的第一步。引物设计有以下几个原则:
(1) 引物最好跨内含子设计(此原则下设计的引物将不受反转录试剂盒中是否含有gDNA Remover的影响);
(2) 引物长度一般在18~30 nt之间,扩增产物长度尽量控制在 80-150bp之间;
(3) GC含量和Tm值,引物GC含量控制在40%~60%之间,Tm值应尽量在55~65℃之间,一般为60℃左右;
(4) 引物3′端末端避免选择A;
(5) 碱基分布:引物中四种碱基的分布是随机的,3′端避免超过3个连续的G或C;
(6) 引物设计区域应避开复杂二级结构;
(7) 引物自身和引物之间应尽量避免碱基连续互补;
(8) 引物扩增的是目标特异产物,设计完成后可以用BLAST检索,确认引物的特异性。
目前引物的设计主要借助一些分子生物学软件或在线工具来实现,常见的引物设计软件有Oligo 6、Primer Premier 5及Primer 3等。
2.RNA提取
RNA提取一般可以使用专业的商品化RNA提取试剂盒,按说明书操作即可,或者TRlzol试剂提取,具体步骤如下:
(1) 样品准备:贴壁细胞:6孔板取1个孔的细胞加入1ml Trizol,室温裂解10 min;悬浮细胞:离心沉淀细胞,每5-10×10^6个细胞加入1ml Trizol室温裂解10 min;组织:50-100mg新鲜组织装入1.5ml EP管放入液氮急冻,加入1ml Trizol冰上匀浆,室温裂解10 min。
(2) 两相分离:每1 ml的TRIZOL试剂裂解的样品中加入0.2 ml的氯仿,盖紧管盖。手动剧烈振荡管体15 s后,15到30℃孵育2到3 min。4℃下12000 rpm离心15 min。离心后混合液体将分为下层的红色酚氯仿相,中间层以及无色水相上层。RNA全部被分配于水相中。水相上层的体积大约是匀浆时加入的TRIZOL试剂的60%。
(3) RNA沉淀:将水相上层转移到一干净无RNA酶的离心管中。加等体积异丙醇混合以沉淀其中的RNA,混匀后15到30℃孵育10 min后,于4℃下12000 rpm 离心10 min。此时离心前不可见的RNA沉淀将在管底部和侧壁上形成胶状沉淀块。
(4) RNA清洗:移去上清液,每1 ml TRIZOL试剂裂解的样品中加入至少1 ml的75%乙醇(75%乙醇用DEPC水配制),清洗RNA沉淀。混匀后,4℃下7000 rpm离心5 min。
(5) RNA干燥:小心吸去大部分乙醇溶液,使RNA沉淀在室温空气中干燥5-10 min。
(6) 溶解RNA沉淀:溶解RNA时,先加入无RNA酶的水40 ul用枪反复吹打几次,使其完全溶解,保存于-80℃待用。
(7) RNA质量检测:
①微量分光光度计检测RNA浓度。先用稀释用的TE buffer将分光光度计调零,然后取少量RNA溶液用TE稀释后,读取其在分光光度计260nm和280nm处的OD值。OD260下读值为1表示40 ng RNA/ml,样品RNA浓度(g/ml)计算公式为:OD260×稀释倍数×40 ng/ml。OD260/OD280的比值在1.8~2.0的范围内为佳。
②变性琼脂糖凝胶电泳检测RNA完整性。2 kb处的28S和0.9 kb处的18S各有一条清晰明亮的条带,而在0.1kb处的5S有一条极淡的条带。长期以来人们使用28S:18S=2:1的比率作为鉴定完整RNA的标准。事实上,大多数样品中提取的RNA几乎达不到这一比值。若2 kb处的28S和0.9 kb处的18S条带明亮清晰且28S:18S>1,则能满足绝大部分实验的要求。
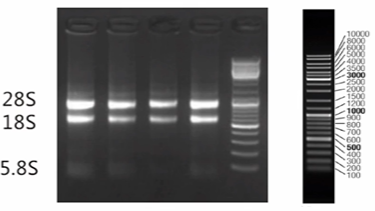
图6.RNA电泳检测图
【注】:因为RNA酶的广泛存在,制备RNA的关键一是要抑制细胞中的RNA酶,二是要防止实验环境及试剂耗材中RNA酶的污染。在实验中必须采取以下措施:戴好手套和口罩;使用 RNA 操作专用实验台;使用0.1%DEPC处理后进行高温高压灭菌的无菌水;RNA实验用的所有试剂都应专用,避免混用后交叉污染。
3.反转录
反转录PCR(Reverse Transcription,RT-PCR)又称为逆转录PCR,是以组织或细胞中提取的总RNA中的mRNA作为模板,采用Oligo(dT)或随机引物利用逆转录酶反转录成cDNA的步骤。
具体方法可参考汉恒生物反转录试剂盒说明书:HBScript cDNA反转录试剂盒。HBScript cDNA合成试剂盒包含gDNA Remover、配套buffer和HBScript cDNA Synthesis Master Mix (5X)。gDNA Remover可去除RNA模板中残留的基因组DNA污染,保证后续结果更加可靠。实验步骤如下:
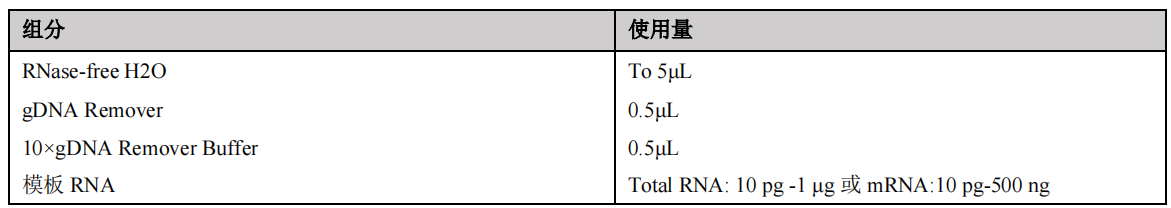
⑴RNA质量检测:
残留基因组 DNA 去除(若引物不能夸外显子设计则必须做这一步)
在RNase free离心管中配制如下混合液,用移液器轻轻吹打混匀。37℃孵育5 min。
(2)逆转录反应体系配制(10μL体系)
反应液配制请在冰上进行。在反应管中直接加入HBScript cDNA Synthesis Master Mix (5X),用移液器轻轻吹打混匀。
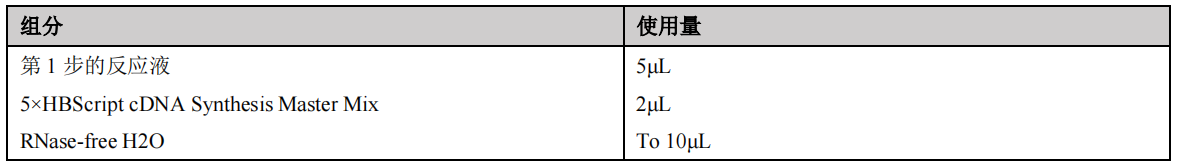
(3)逆转录程序设置

【注】:逆转录温度推荐使用42℃ ,对于高GC含量模板或者复杂模板,可将逆转录温度提高到60℃。反应时间推荐使用15min,长片段PCR需适当延长反应时间。不同试剂盒的反应体系和条件不同,需根据说明书介绍摸索最适条件。
4.Real Time PCR
以反转录得到的cDNA为模板进行PCR扩增,步骤如下:(参考汉恒生物qPCR试剂盒:HBStart Green qPCR Premix,此试剂盒所使用的是SYBR Green I 荧光染料,采用嵌合荧光检测法。)
(1)反应体系的配制(10/20 μL体系)

【注】:I、DNA模板的添加量通常在100 ng以下,不同类型的模板目的基因拷贝数有所差异,必要时可进行梯度稀释,确定合适的模板添加量;建议模板用量不超过总体系的10%。
II、不同仪器适用的反应体系总体积不同,需根据仪器推荐体系调整试剂用量
(2)PCR 程序
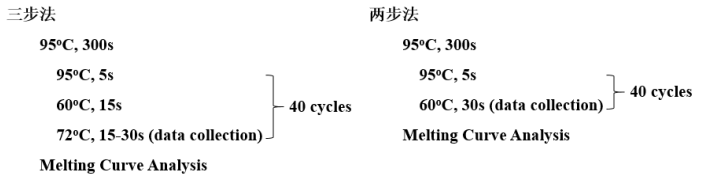
通常使用两步法进行PCR扩增,即只有“变性”→“退火延展”两个温度变化。当使用Tm值较低的引物或者两步法扩增性能较差时,可以尝试三步法,即有“变性”→“退火”→“延伸”三个温度变化。两步法适用于扩增较短的目的片段,用时短。三步法则可以扩增较长的目的片段,用时较长。如果想得到更加严谨的数据,三步法更合适。
(3) PCR结果
反应结束后确认RT-qPCR 的扩增曲线和融解曲线,进行 PCR 定量时制作标准曲线等。分析方法参见仪器操作手册。
5.数据分析
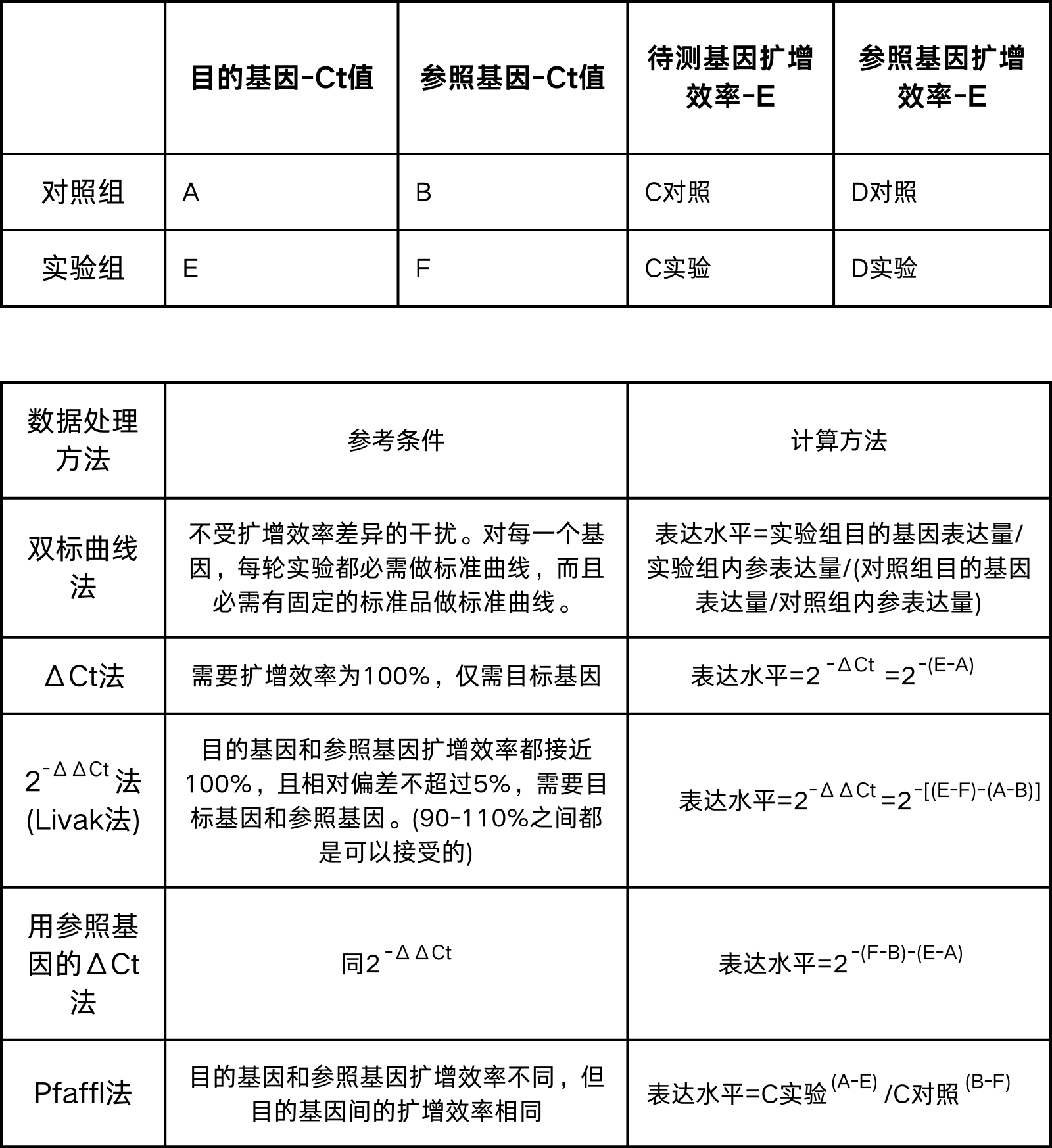
一般有相对定量和绝对定量两种分析方法,相对定量是检测实验组和对照组中靶基因的倍数差异,特别适合在对RNA模板的数量不能精确定量,或者只需要知道目的基因的表达差异时,另外,相对定量需要进行归一化处理。绝对定量是用一系列已知浓度的标准品制作标准曲线,在相同的条件下目的基因测得的荧光信号量同标准曲线进行比较,从而得到目的基因的量;该标准品可以是纯化的质粒DNA,体外转录的RNA,或者是体外合成的ssDNA;绝对定量特别适合在需要知道每毫升样品中的某基因的拷贝数时,另外,绝对定量需要校准。下面我们详细介绍相对定量的分析方法。
相对定量数据分析方法有双标曲线法,ΔCt法,2-ΔΔCt法(Livak法),用参照基因的ΔCt法和Pfaffl法,其中最常用的是2-ΔΔCt法(Livak法),具体分析方法如下:
三、RT-qPCR常见问题分析
1.熔解曲线出现多峰
·引物设计需要优化:应避免引物二聚体和发夹结构的出现,根据引物设计原则重新设计引物;必要时可以设计多对引物做预实验,选取最优的用于后续实验;引物二聚体在熔解曲线内峰值一般位于75℃左右。
·引物浓度过高:适当降低引物的浓度,引物的理想终浓度为200 nM,必要时可将浓度降低至60 nM。
·镁离子浓度过高:适当降低镁离子浓度,必要时更换更合适的mix试剂盒。
·模板有基因组的污染:RNA提取过程中避免基因组DNA的引入,必要时重新制备模板。
2.无Ct值出现
·扩增效率问题:对PCR产物进行电泳检测,观察是否有条带。若没有条带,需要排查引物、模板以及反应条件等问题。引物或探针降解:可通过PAGE电泳检测其完整性。
·引物或探针降解:可通过PAGE电泳检测其完整性。
·模板量不足或者目的基因表达丰度过低:对未知浓度的样品应从最高浓度做起,通常所需cDNA量为1-100ng。如果目的基因表达丰度过低,那就需要更多的样本量。
·模板降解:重新制备模板,避免样品反复冻融。
·程序设置是否不当:一般SYBR Green I法采用72℃延伸时采集信号,Taqman法则在退火结束时或延伸结束采集信号。
3.Ct值偏大(Ct>35)
·Ct值最好控制在15-30之间。
·扩增效率低:反应条件不够优化。设计更好的引物或探针;改用三步法进行反应;适当降低退火温度;增加镁离子浓度等。
·PCR各种反应成分的降解或加样量的不足。
·PCR产物太长:一般采用80-150bp的产物长度。
4.扩增曲线的异常
·仪器设置不当,比如说基线设置不当,阈值设置不当,参比染料设定不正确等。
·反应体系引起的:扩增效率过高或过低,模板的浓度太高或者降解。可以对目的基因做标准曲线评估反应效率。
·荧光染料的降解。
5.标准曲线线性关系不佳
·当扩增效率为100%时,斜率为-3.32,当斜率在-3.10 ~ -3.58范围内,即扩增效率为90% ~ 110%时,都属于正常范围。R2最佳值为1,一般大于0.98即可。
·加样存在误差:加大模板稀释倍数,提高加样体积。
·标准品出现降解:应避免标准品反复冻融,或重新制备并稀释标准品。
·引物或探针不佳:重新设计更好的引物和探针。
·模板中存在抑制物,或模板浓度过高。
6.阴性对照有信号
·引物设计不够优化:应避免引物二聚体和发夹结构的出现。
·反应体系组分被污染:更换新的mix或者DEPC水。
·环境污染:反应体系在RNA实验专用超净工作台内配置,减少气溶胶污染。
7.其他注意事项
·不同公司的qPCR仪器适配的耗材和试剂可能不同,提前阅读仪器说明书或咨询仪器工程师、实验室人员等确认,仪器和耗材或试剂不兼容可能会导致结果偏差。
·qPCR板上不能做标记,极有可能影响荧光信号的采集,若担心加样有误可使用实验记录本协助记忆。
·多数仪器光源要求使用2000h后进行更换。
至此,RT-qPCR实验详解内容就结束了,小伙伴是否觉得RT-qPCR并没有想象中那么难呢?如果大家在实验过程中有任何问题也欢迎来和小恒讨论。下期我们将开始介绍WB相关内容,感兴趣的同学可以留意一下哦~

查看更多

查看更多

查看更多

联系我们

返回顶部