查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
前面几期干货已经介绍了如何进行载体构建、转染以及qPCR检测目的基因表达变化,本期小编将继续向大家介绍如何用Western blot实验检测目的基因的表达情况。

蛋白质印迹法(Western blot,WB)是一种利用“抗原-抗体”特异性结合来检测组织或细胞样品中特定蛋白质表达水平的常用方法。作为一种经典的实验方法,WB实验看似简单,但大家却经常为得不到漂亮的WB结果图而苦恼,今天的干货文章将为大家解决这一烦恼。
1. 实验原理
蛋白免疫印迹( Western Blot,WB)是将蛋白样本通过聚丙烯酰胺电泳按分子量大小分离,再转移到杂交膜(blot)上,然后通过一抗/二抗复合物对靶蛋白进行特异性检测的方法。 WB 是进行蛋白质分析最流行和成熟的技术之一
2. 实验步骤
Western blot实验步骤可以分为蛋白样品的准备(包括蛋白质的提取和定量)和SDS-PAGE电泳(包括电泳、转膜、封闭、孵育一抗、孵育二抗和显影)这两大块内容。接下来我们看下Western blot实验的具体步骤。
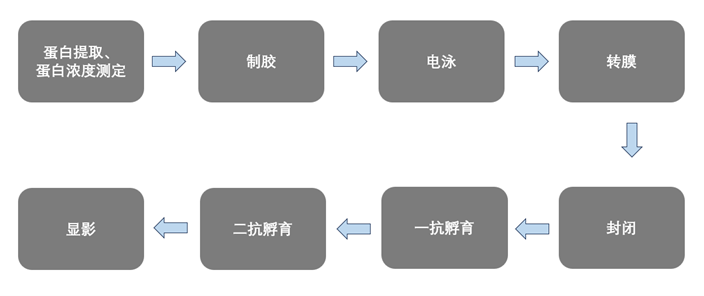
Western blot实验流程图
2.1 蛋白质的提取
成功提取出高质量的蛋白,WB实验便成功了一半。接下来,我们先看看蛋白质如何提取。由于质粒或者病毒载体携带的外源基因转染细胞后36-48小时左右达到表达高峰,因此建议在这个时间收集并裂解细胞。具体步骤如下:
① 裂解细胞:裂解过程中一般会用到RIPA裂解液(其原理是通过组合离子型去垢剂和非离子去污剂对组织、细胞的消化作用,使组织、细胞崩解释放出蛋白质)。将培养基吸走,用预冷的PBS缓冲液漂洗细胞三次,吸净PBS后,按照0.1 ml /106 cells加入适量的RIPA裂解液(含有1%的蛋白酶抑制剂,其可抑制各种蛋白酶的水解作用,防止蛋白降解,保证蛋白产量和完整性),用细胞刮刮下细胞后转入到离心管中。
② 蛋白分离:将离心管放在冰上30min以充分裂解细胞,然后4℃条件下,10000 rpm离心5min,转移上清至一个新的离心管中,蛋白在上清中,若暂时不做任何处理可以-80℃保存。
2.2 蛋白质的定量
Wb实验中需要对各组蛋白样本进行定量,以保证上样量一致。目前,蛋白定量一般采用BCA或Bradford法,这里介绍BCA法测定蛋白浓度的具体事宜。BCA蛋白质定量法的原理是利用双缩脲反应,在碱性条件下,蛋白质中的肽键与铜离子(Cu2+)反应,生成可溶性的络合物。络合物的形成量与蛋白质浓度成正比,可以通过测定络合物的吸光度来推算蛋白质浓度。
BCA法测定蛋白浓度的具体步骤如下:
① BCA工作液配制:根据样品数量的多少,将BCA 试剂的A和B液按A:B=50:1的比例配制适量的BCA 工作液。
② 制备蛋白标准品:把蛋白标准品粉末加入1.5ml 离心管,加入超纯水充分溶解后配制成20mg/m1的蛋白标准溶液,配置好的蛋白标准品在-20℃保存,实验过程中取适量的蛋白标准品稀释成 0.5mg/ml。
③ 标准品及蛋白样品OD值的测定:先将蛋白标准品稀释成 0.5mg/ml,然后将标准品按0、1、2、4、8、12、16、20μl以及适量体积蛋白样品加到96孔板中,用标准品稀释液补足各孔体积至20μl,标准品浓度分别为0、0.025、0.05、0.1、0.2、0.3、0.4、0.5mg/ml,最后向各孔加入 200μl BCA 工作液,在 37 恒温箱放置20-30分钟。在A562nm用酶标仪测定吸光度(OD值)。
④ 蛋白浓度计算:在excel中处理③所得数据,绘制标准曲线,根据标准曲线公式及待测蛋白样品OD值计算待测样品蛋白浓度。
2.3 SDS-PAGE凝胶的制备
SDS-PAGE凝胶包括浓缩胶和分离胶。浓缩胶浓度低、孔径大,分离胶浓度高、孔径小。在电场的作用下,蛋白质颗粒在大孔胶中遇到的阻力小,移动快。而在小孔胶中遇到的阻力大,移动慢。因此,在两层凝胶的交界处,由于凝胶孔径的不连续性使样品迁移受阻而压缩成很窄的区带。样品进入分离胶后,分子量越小的蛋白移动越快,分子量越大的蛋白移动越慢,从而将样品中的蛋白按分子量大小进行分离。
①分离胶制备:制备凝胶前,先清洗干净玻璃板,将玻璃板对齐后夹中卡紧,垂直卡在架子上,并标注好灌胶位置。根据需要配制好适当浓度分离胶,将其缓慢加入玻璃板之间,避免气泡产生。液面到达表标注灌胶位置时,缓慢加入纯水或饱和正丁醇待胶凝固,大约40分钟当水和胶之间有一条直线时说明已经凝固。
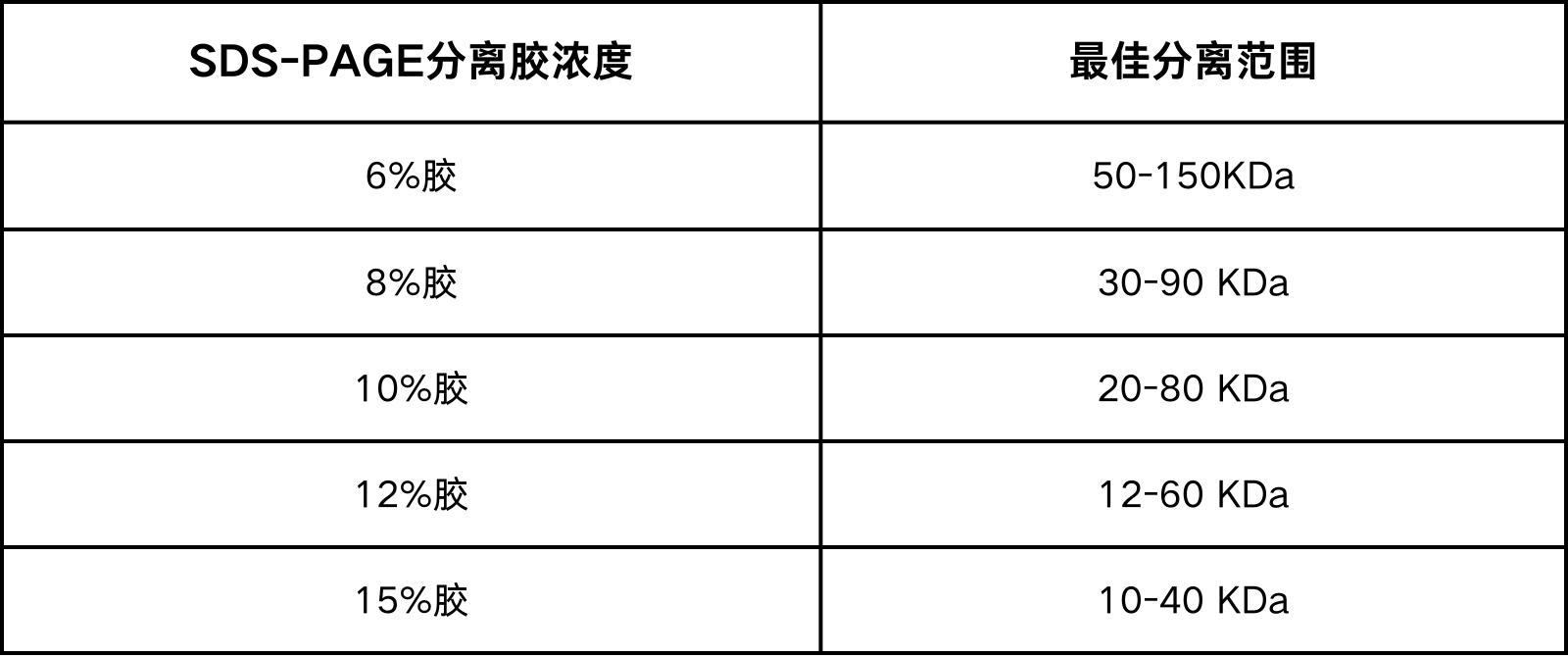
注:不同浓度分离胶适用分离范围如下表所示,根据所分离的目的蛋白分子量选择适当的分离胶浓度。
②浓缩胶制备:分离胶凝固后用滤纸将分离胶上面的液体吸干,便可以进行浓缩胶的制备和灌注。在烧杯中配制好浓缩胶后,灌注配置好的浓缩胶后,迅速插入合适的梳子,浓缩胶凝固后,就可以进行接下来的电泳实验了。
2.4 SDS-PAGE电泳
制备好SDS-PAGE凝胶后,便可以按如下步骤进行上样电泳了。
①准备电泳装置:
先卸去二块玻璃板制成的凝胶板子上的夹子,然后将凝胶板垂直靠在电泳槽里的电源架上,使凝胶板的凹沿面靠向电源架,通常两块凝胶板共用一个电源架。将凝胶板与电源架按要求固定于电源槽内,加入电泳缓冲液,使分别加入在两块凝胶板之间的电泳缓冲液与加入在电泳槽中的电泳缓冲液互不相通,然后轻轻地拔去凝胶板内的梳子。
②对照设置:
一般需要设置阳性对照(确保在正确WB实验操作没有问题的情况下肯定可以出现正确条带的蛋白样品)和阴性对照(一般为未表达或缺失对应蛋白的样品)。并且至少留出一个孔用于加蛋白预染Marker,以便观察电泳效果与转膜效果。一般将阳性对照和阴性对照放在凝胶孔的开始和结束位置,以便于结果的比较。凝胶两侧空置的泳道用等体积的1x Loading Buffer补齐,防止边上的样品条带上扬,影响结果。
③上样样品准备:
一般抗体只能识别抗原蛋白中的抗原表位序列,因此,为使抗体能够达到结合该表位,需要将蛋白样本进行变性,使之打开折叠的空间结构。蛋白变性一般使用含阳离子变性去污剂如 SDS 的上样 buffer (loading buffer),并于 95-100°C 煮沸5 min,对于多次跨膜蛋白,可以于 70°C 加热 5-10 min。一般 上样 buffer 为5×SDS加样缓冲液,上样时与样本1:4混合后变性上样即可。
注:为方便上样,变性前可先取适量各蛋白样本稀释至同一浓度后再加入1/4体积5*SDS加样缓冲液进行变形处理
④上样:
用微量进样器吸取适量样品液,按照②中的设置将样品液缓缓加入凝胶板内地凹口部位(样品点入处),再缓慢抽出枪头,以免蛋白样品飘出凝胶孔,造成实验误差。每个孔的蛋白上样量在10-50ug为宜,体积控制在20ul左右。尽量保持每个泳道的蛋白量一样,体积尽量一致,方便后续观察蛋白的表达量。
⑤电泳:
随后用导线连接电泳槽与电泳仪,注意红色与黑色电极的插头和插口相配。电泳时上层胶使用低电压恒压电泳,打开电源将将电压调到80v(一般15min左右),而在溴酚蓝进入下层胶时使用高压恒压电泳,将电压调到120v至溴酚蓝到达胶的底端处附近即可停止电泳。
2.5转膜
转膜方法分为湿转和干转,湿转法是在转膜液中进行,干转法是不放在转膜液中进行,湿转法的稳定性要好于干转法。这里介绍的是湿转法转膜步骤。
①提前制备好转膜液,用剪刀剪取合适大小的PVDF膜(或NC膜),在甲醇溶液中放置几分钟使其激活,再用转膜液洗三次,最后浸泡于转膜缓冲液中备用。
②制备好滤纸和海绵,并浸泡于转膜缓冲液中待用。
③电泳结束后用塑料切胶板轻轻撬动玻璃边角,打开玻璃板,根据Marker条带指示的位置,留下目的蛋白和内参基因所在的胶,将多余凝胶切除(也可整张胶直接转膜)。将凝胶放入转膜三明治结构中进行转膜操作。转膜三明治结构的组装方法如下:黑色板(负极)→海绵垫→3层滤纸→凝胶→PVDF膜→3层滤纸→海绵垫→红色板(正极)。
④然后将转膜三明治结构垂直放入缓冲槽中,倒入转膜缓冲液直至没过转膜三明治结构,盖上盖子,接通电源进行转膜。一般转膜的电流在200mA-400mA之间,转膜时间为30-60分钟。具体的转膜时间要根据目的蛋白的大小来决定,目的蛋白的分子量越大,需要的转膜时间越长。
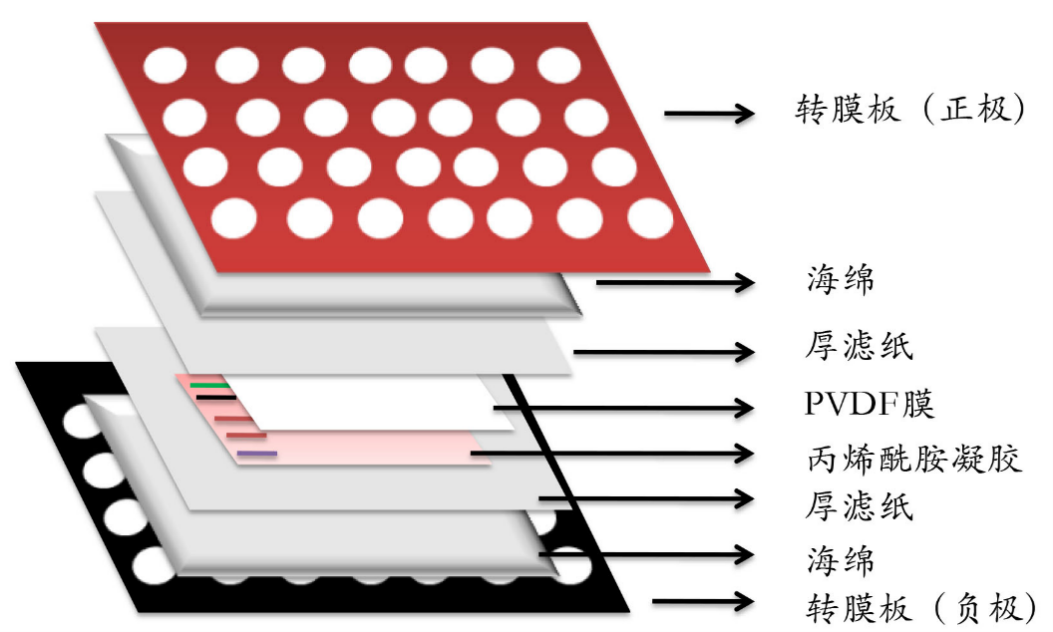
转膜三明治结构示意图
2.6 封闭:
当观察到PVDF膜上面有Marker条带,且凝胶上没有蛋白Marker的残留,表示转膜成功了,就可以进行封闭处理了。
杂交膜上有很多非特异性的蛋白质结合位点,用惰性蛋白质或非离子去污剂封闭膜上的未结合位点,可防止这些位点与抗体结合引起非特异的染色和背景。封闭剂应具备封闭所有未结合位点而不替换膜上的靶蛋白、不结合靶蛋白的表位,也不与抗体或检测试剂有交叉反应得特点。v最常见的封闭剂是 BSA、脱脂奶粉、酪蛋白、明胶和 Tween-20(0.05 - 0.1%)稀溶液 PBST 或者 TBST,其中脱脂奶粉与BSA又最为常用。封闭时,用5% 脱脂奶粉或 BSA 溶液室温或者 37℃缓慢摇荡 1-2 h,特殊情况也可 4℃过夜。
注:脱脂奶粉不能与生物素化或伴刀豆蛋白标记的抗体一起使用,因为脱脂奶粉含有糖蛋白和生物素。如果封闭剂中含磷酸酶,用磷酸化特异性抗体分析磷酸化蛋白受到影响,因为磷酸酶与印记膜上的磷酸化蛋白接触可使之去磷酸化。检测磷酸化抗体时,不能使用酪蛋白/脱脂奶粉作为封闭剂。某些抗体用 BSA 封闭时因不明原因可能会产生比脱脂奶粉更强的信号,请仔细阅读说明书注明的注意事项和膜的特殊的封闭方法。
2.7一抗孵育:
将封闭的PVDF膜用 TBST 清洗一遍,加入稀释过的一抗液(稀释方法参考说明书)中,4℃摇床缓慢摇动孵育12小时左右。
注:一抗的孵育时间可从2h至过夜(一般不超过 18 h)不等,取决于抗体与蛋白的亲和性和蛋白的含量丰度,建议使用较高的抗体稀释倍数和较长的孵育时间来保证特异性结合。
2.8 二抗杂交:
一抗孵育结束后,将PVDF膜在摇床上用TBST溶液清洗三遍,每次10分钟左右,然后加入稀释过的二抗液(稀释方法参考说明书)室温震荡孵育1小时左右。
2.9 显色:
二抗孵育完成后,将膜用TBST溶液摇床清洗三次,每次10分钟左右,然后即可进行显色。显色液一般是使用ECL(enhanced chemiluminescence),现配现用。将ECL试剂工作液的A液和B液按照1:1等体积混合于离心管中,然后将其滴在膜上使其充分浸润大约1-2min,将膜上的残液去尽,在暗室中放入显影仪中进行显影。选择不同的曝光强度调整结果,并将照片进行保存,用于数据分析。Image J软件处理系统是一种常用的蛋白灰度分析软件。具体操作步骤如下:
a、打开lmage J,导入图片,将图片转化为灰度图片。lmage→Type→8 bit。
b、消除背景影响Process→rocess→Subtract Background→选择50 pixels和Light back ground。
c、设定参数→Analyze→Set Measures按照下图勾选参数。
d、设定参数→Analyze→Set scale→unit of length选项改为pixels。
e、图像分割→Edit→Invert→选用椭圆或自定义工具选中条带。
f、Analyze→Measure→得到IntDen值。
g、重复Step5、6,得到所有条带的IntDen值。
h、将结果导出excel表格,在excel表格中进行归一化处理,将目的蛋白的灰度值除以内参蛋白的灰度值,以分析样品中蛋白表达情况。
3. Western blot实验常见问题及原因:
1、在制胶时,出现漏胶现象是什么原因呢?
首先有可能是接触面不平整,或者有可能是胶条老化;其次观察玻璃板边缘(与胶条接触处)有没有发生破损,如果有破损应更换没破损的玻璃板;最后观察玻璃和胶条之间有没有贴紧。
2、蛋白条带大小与理论值不符,可能是什么原因?
可能的原因有:
① 蛋白质本身可能有修饰如糖基化、磷酸化等均会增大蛋白分子量;
② 蛋白可能发生了翻译后剪切,可查阅文献,确认蛋白是否存在多种剪切活性形式;
③ 所检测的抗原可能形成了二聚体或多聚体,可以延长蛋白样品煮沸时间,打开蛋白二聚体或多聚体。
3、WB结果无信号或信号很弱的可能原因及解决方案?
出现这种情况有可能是以下原因:
① 目标蛋白浓度过低或者蛋白降解导致检测不到,这种情况应提高上样量,裂解液中注意加入蛋白酶抑制剂并在冰上裂解细胞或组织;
② 一抗孵育时间不足,建议4℃孵育过夜;
③ 二抗与一抗不匹配,订购试剂时认真选取针对一抗种属的二抗;
④ 抗体失活或抗体浓度过低,建议更换确定好用的抗体来检测;
⑤ 膜洗脱过度,建议合理控制洗脱时间和频率,一般是洗3次每次10分钟。
4、跑的WB条带不整齐,可能是什么原因?
① 胶凝固不均匀,可以等胶完全凝固后上样;
② 电泳时,有气泡在胶的下边缘,建议电泳前,检查并赶出气泡;
③ 上样buffer不是工作液浓度,建议重新配置;
④ 拔梳子导致样品孔不齐,建议水平缓慢拔梳子
5、WB实验内参表达量不统一可能的原因及调整方案?
这种情况可能的原因有:
① 蛋白定量不准确导致加样误差太大,这种情况下,按照内参的灰度值调整上样量即可;
② 点样时由于移液枪不准导致加样误差,此时需要更换更准的移液枪;
③ 内参选择不合适,不同组织或不同处理的实验组所需的内参是不同的,应该根据实验选择正确的内参;
④ 也有可能是抗体的原因,建议更换确认好用的抗体哦。

查看更多

查看更多

查看更多

联系我们

返回顶部