查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
前几期干货为大家介绍了基因/蛋白表达水平的调控及检测方法,本期小编将为大家继续介绍免疫荧光技术,具体包括免疫荧光的定义、免疫荧光的实验原理、免疫荧光的实验步骤、免疫荧光技术的应用和免疫荧光实验的常见问题及解析等五大方面。

一 、免疫荧光的定义
免疫荧光(Immunofluorescence,IF)是将免疫学、生物化学和显微镜技术联合应用建立起来的一种可视化示踪的技术,主要是利用荧光素标记的抗体作为探针对样品内靶标抗原进行定位和定性分析,由于其具有靶向特异性强、灵敏度高、检测效率快、直观性强等优势,该技术被广泛用于基础科学及临床医学的研究(细胞结构、功能以及多种蛋白质定位等)。随着多重免疫荧光技术的快速发展,在神经科学、环境科学、农业科学及临床诊断上的应用也越来越广泛。
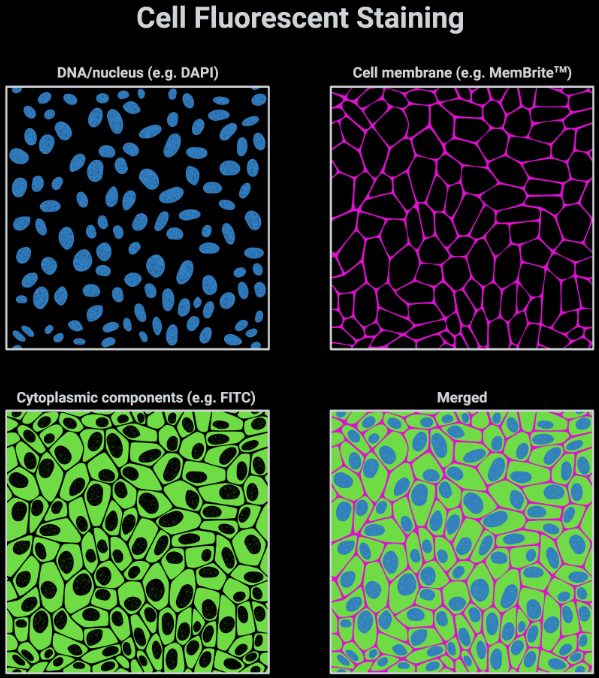
图1. 免疫荧光细胞示例图
二 、免疫荧光的实验原理
免疫荧光实验是通过将已知的抗体标记上荧光素,再用荧光抗体检测组织或细胞内的抗原,荧光素受激发光的照射而发生明亮的荧光,可以看见荧光所在的组织细胞,从而确定抗原的性质、定位,以及利用定量技术测定其含量。与免疫组织化学实验相比,免疫荧光法在信号放大、靶向特异性、分辨率等方面具有明显的优势,可以通过各种显微镜技术直接观察。接下来,我们介绍不同类型免疫荧光染色和信号放大的检测方法。
根据实验目的或使用的特定抗体,免疫荧光检测方法可分为直接免疫荧光法(一级)和间接免疫荧光法(二级)。在直接免疫荧光法中,荧光标记与一抗结合,直接结合到靶标抗原上。而间接免疫荧光法涉及两步孵育过程:1)一抗结合靶表位,2)荧光标记的二抗识别并结合一抗。虽然直接免疫荧光法检测更快,但间接免疫荧光法因其高灵敏度、信号放大优势以及在同一样本中检测多个靶标的能力而被更广泛地采用。
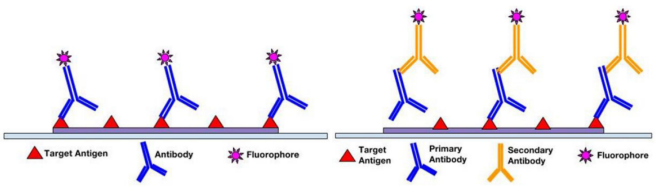
图2. 免疫荧光检测法[1](左:直接IF法;右:间接IF法)
为了实现可视化和荧光信号的放大,可以通过多种方式修饰和偶联二抗。主要方法包含:① 使用多克隆二抗,多克隆二抗能够识别一抗的多个抗原的表位,以提高结合和信号水平(图3a);② 多种荧光染料蛋白复合物可以与单一的生物素化二抗结合,以提高信号水平(图3b);③ 结合多个荧光团-蛋白复合物的多克隆二抗组合可以用于荧光信号的进一步放大(图3c)。
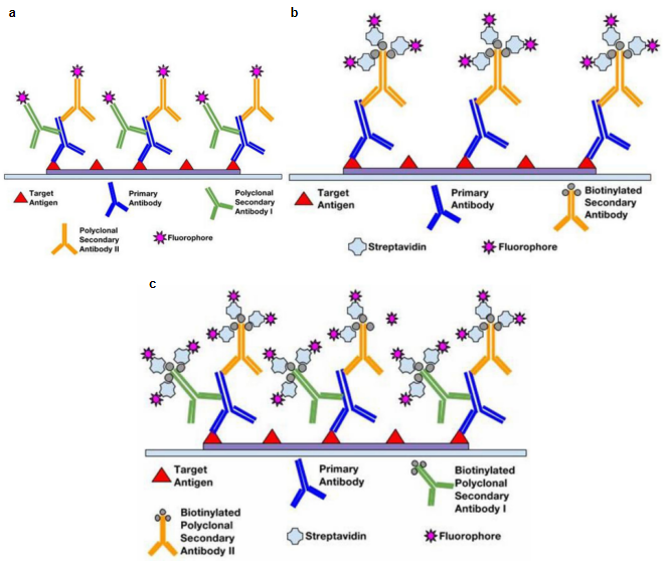
图3. 不同方式修饰和偶联二抗示例图[1]
三 、免疫荧光的实验步骤
1. 样品准备:根据实验需求,准备不同的样品。针对贴壁细胞,可将洁净的盖玻片放置在培养皿中,待细胞接近长成单层后小心取出盖玻片,也可直接在细胞培养板或共聚焦皿中进行后续实验;针对悬浮细胞,可在悬浮液中进行固定、染色、离心洗脱后,用移液管移至载玻片进行后续抗体孵育;针对组织样品,可能需要进行脱蜡、再水化和抗原修复处理等。
2. 固定:使用固定液对样品进行固定,以防止自溶和抗原扩散。固定的时间和方法取决于抗原的性质及抗体的特性。例如,常使用4%的多聚甲醛固定细胞10 ~ 15 min。
3. 洗涤:使用PBS缓冲液清洗3次,以去除残留的固定液。
4. 抗原修复:前期的固定过程可能会发生交联,交联过程会导致抗原发生封闭现象,使目标抗原无法准确显露出来,最终导致假阴性结果,从而影响免疫荧光结果的判断。常用的抗原修复方法包括高温高压、微波加热或酶处理等。(该步骤可选)
5. 通透:使用Triton X-100等去垢剂或醇类试剂进行通透处理,以使抗体能够进入细胞内部。通透时间通常为5 ~ 20 min。(该步骤可选;通透步骤会破坏细胞膜,细胞膜表面抗原不适合选择通透实验)
6. 洗涤:使用PBS缓冲液清洗3次,以去除残留通透液。
7. 封闭:添加山羊血清或牛血清白蛋白(BSA)等封闭液覆盖样品,以减少一抗/二抗与非特异性抗原位点的结合。室温或37 ℃封闭30 ~ 60 min。
8. 一抗孵育:根据研目标抗原和样品特性选择符合要求的一抗,并按照说明书要求稀释一抗,加入到样品中并在4 ℃条件下孵育过夜(12 ~ 16 h)。
9. 洗涤:回收一抗工作液,用TBST或PBST摇床缓慢清洗3次,每次5~10 min,以去除未结合的抗体。洗涤次数和时间可根据实验条件调整。
10. 二抗孵育:根据一抗的种类及样品特性(二抗携带的荧光需要与样品自带荧光不冲突)选择合适的荧光标记的二抗,在室温下避光孵育1 h。稀释和使用方法应遵循说明书。
11. 洗涤:去除/回收二抗工作液,用TBST或PBST摇床缓慢清洗3次,每次5 ~ 10 min,以去除未结合的抗体。洗涤次数和时间可根据实验条件调整。
12. 染核:为直观地区分细胞核和其他细胞及抗原结构的位置,可使用含DAPI的抗荧光淬灭封片剂对样品进行染核和封片处理,通常在室温下进行,孵育5 ~ 20 min。
13. 成像及分析:最后,在荧光显微镜或激光共聚焦显微镜下观察并采集图像,并对荧光定位及结果进行实验分析。
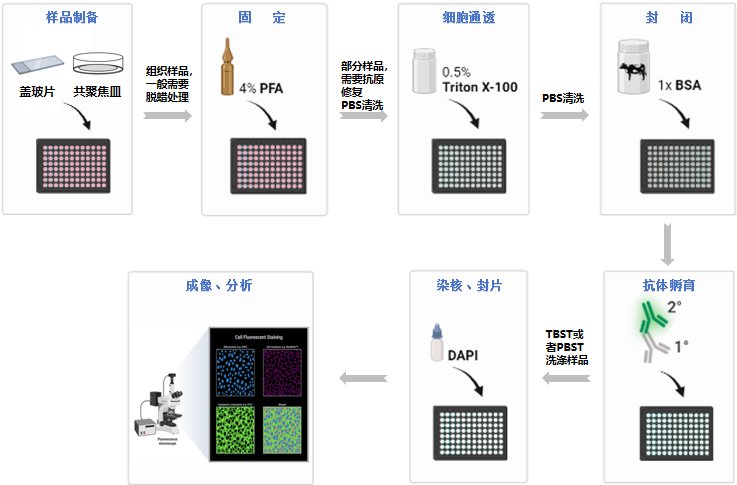
图4. 免疫荧光实验操作步骤图
四、免疫荧光技术的应用
免疫荧光技术对于基础实验研究和临床医学研究的应用助力是极为广泛的,例如药物对蛋白的作用影响、蛋白的特异性表达、细胞表面抗原的检测、肿瘤特异性抗原检测、病毒的快速确认以及血清中抗体的检测等等。接下来,我们分析几个主要的免疫荧光技术的实际应用案例。
1、用于靶标蛋白及表达特异性定位的研究
2022年3月24日,滨州医学院肾脏生理与疾病研究团队在《Nature Communications》杂志在线发表了题为“Loss of CLDN5 in podocytes deregulates WIF1 to activate WNT signaling and contributes to kidney disease”的研究论文。该研究首次揭示了足细胞紧密连接跨膜蛋白CLDN5可调控WNT通路抑制分子WIF1的表达并参与肾脏病的发生发展。其中免疫荧光染色显示,CLDN5在Cldn5podKO肾脏中没有与NPHS2共定位,但在小动脉内皮细胞中有信号,证实NPHS2-cre介导的CLDN5缺失主要局限于足细胞。
免疫荧光实验方法:用4%多聚甲醛固定I型胶原包被盖片上的原代足细胞,然后用10% FBS阻断后,用合适的一抗孵育,使用FITC和/或罗丹明偶联的二抗进行孵育,并使用ProLongTM Gold抗淬灭封片剂封片。对免疫荧光图像进行采集并使用Zen Software v2.3处理。
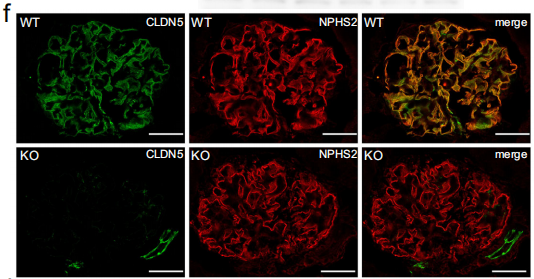
图5. WT和CLDN5KO小鼠肾切片的CLDN5和NPHS2免疫染色[2]
2、用于细胞器定位的研究
2017年5月11日,瑞典皇家理工学院在《Science》杂志上发表了题为“ A subcellular map of the human proteome”的研究论文。研究团队整合了人类转录组学、免疫荧光技术和质谱验证等,首次绘制出了人体蛋白质亚细胞结构分布的全景图,在单细胞水平将由13993种抗体靶向的12003种蛋白定位到30个细胞区室和亚结构中,在细胞图谱中定义了13个主要细胞器的蛋白质组和一个分泌组。为精确分析蛋白定位及研究高度复杂的亚细胞结构组成提供了重要的参考信息。
免疫荧光实验方法:将细胞接种于涂有纤维连接蛋白的96孔板中,培养至60-70%的融合度,使用4%多聚甲醛固定15 min,用0.1% Triton X-100渗透3 x 5 min。PBS洗涤后,一抗在4 ℃下孵育过夜。次日,PBS洗涤后,室温下二抗孵育90 min。然后用DAPI复染细胞10 min。PBS洗涤后,用78%的PBS-甘油完全填充并密封。
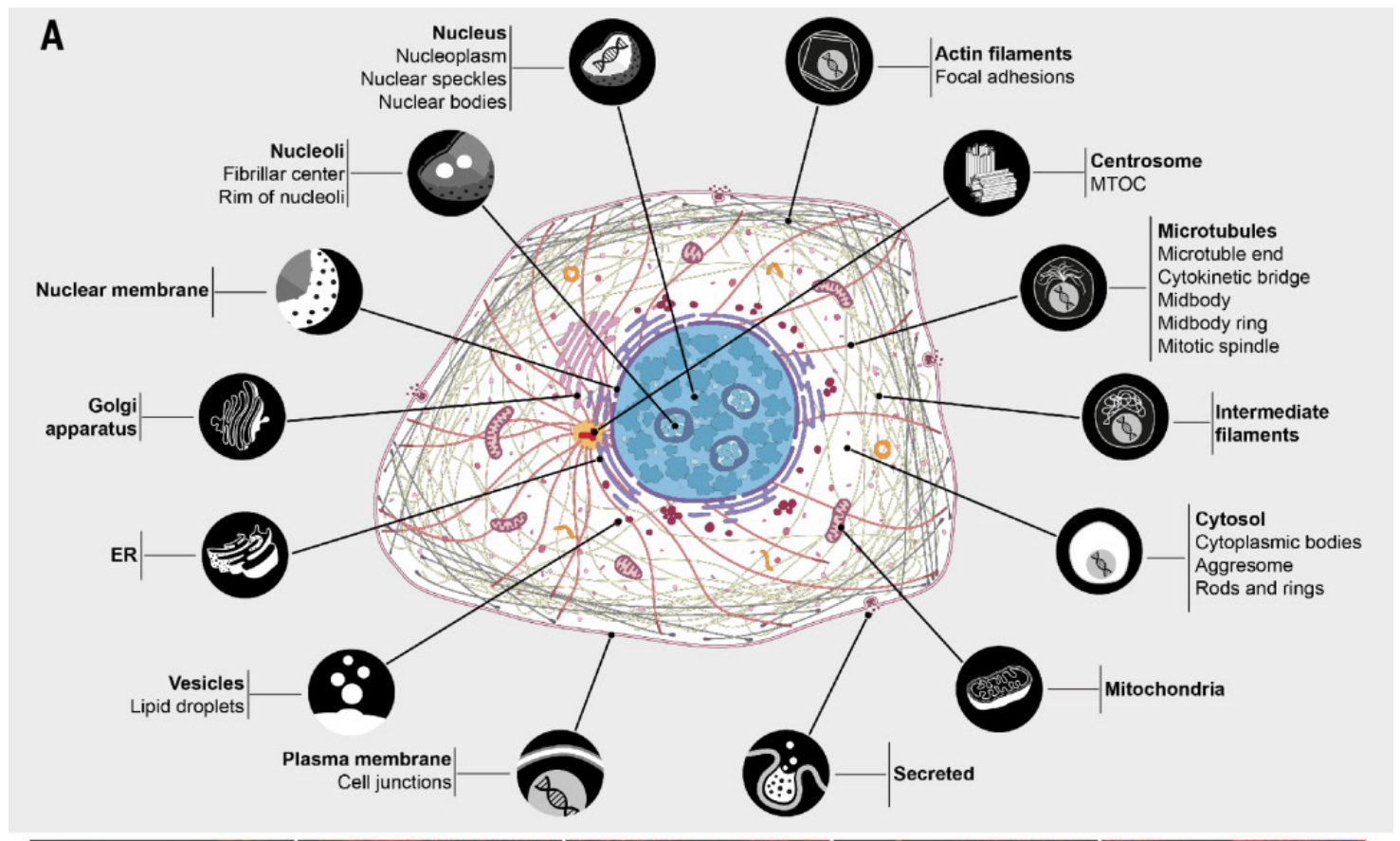
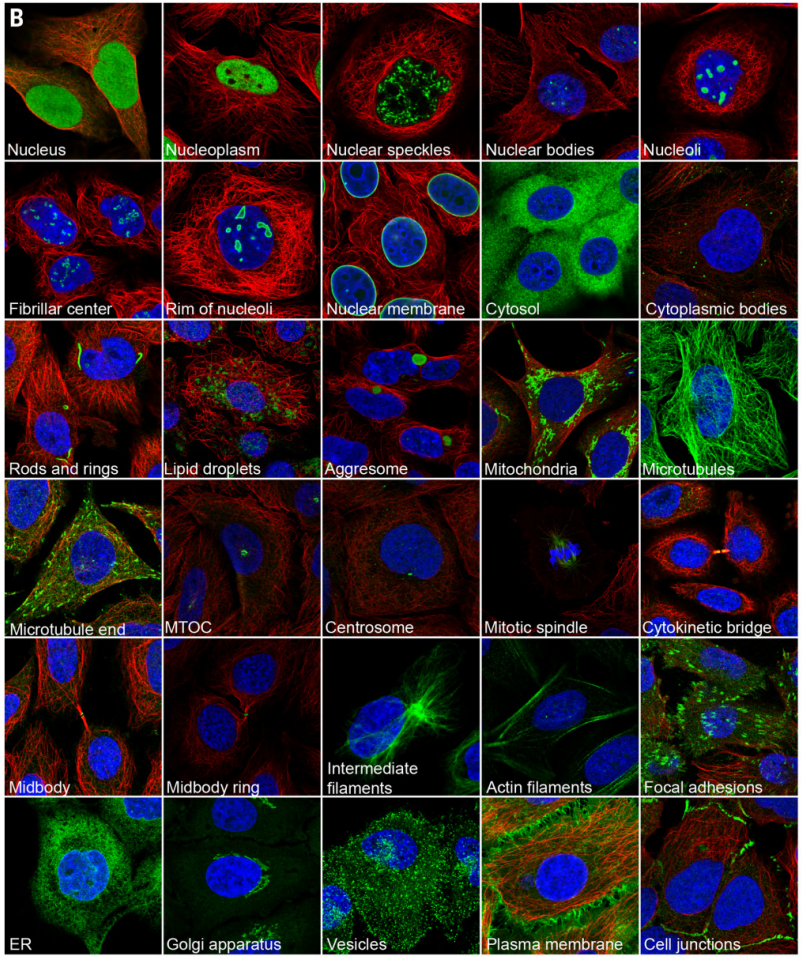
图6. 免疫荧光标注亚细胞结构[3]
(绿色:细胞结构的蛋白质;红色:微管;蓝色:细胞核)
3、定量多重免疫荧光(qmIF)用于分析肿瘤免疫微环境
2019年2月,美国哥伦比亚大学系统生物学系的Junfei Zhao和Andrew X. Chen在《Nature Medicine》杂志发表了题为“Immune and genomic correlates of response to anti-PD-1 immunotherapy in glioblastoma”的关于胶质母细胞瘤(glioblastomas,GBM)免疫治疗的文章。研究分析了17位患者应答PD-1抑制剂治疗前后的石蜡包埋染色样本,发现CD68+HLA-DR-的巨噬细胞在PTEN突变的样本中比例显著升高,而免疫治疗后,PTEN野生型的样本中CD3+T细胞(CD8+/-)密度显著升高,PTEN突变型样本中则不具有相关变化。通过比较胶质母细胞瘤患者中应答PD-1治疗有效和无效人群的基因组以及转录组,发现影响PD-1抑制剂作用于胶质母细胞瘤中的关键通路和重要基因突变模式,对于指导临床GBM的免疫治疗具有重要意义。
免疫荧光实验方法:收集肿瘤样本福尔马林固定、石蜡包埋,在载玻片上进行多重染色,检测CD3(T细胞)、CD8(细胞毒性T淋巴细胞)、CD68(小胶质细胞/巨噬细胞)、HLA-DR(活化标志物)、PD-L1(免疫抑制标志物)和SOX2(肿瘤标志物)。使用Vectra™进行全载玻片扫描采集图像,使用inForm™软件对至少99%组织的所有区域采集多光谱图像(MSI),以消除自发荧光,并评估肿瘤微环境中免疫表型的密度。
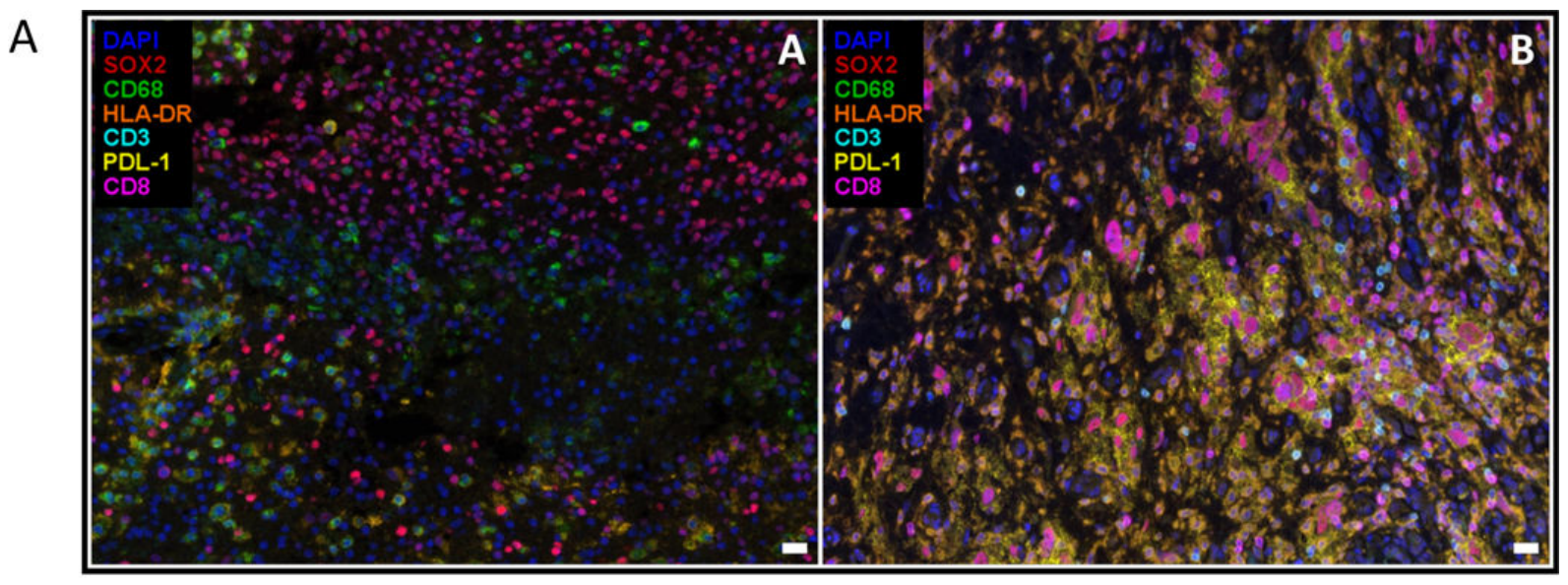
图7. 通过定量多重免疫荧光分析肿瘤微环境[4](无应答(左)和应答(右))
五 、免疫荧光实验的常见问题及解析
Q1:抗体的选择与转染实验荧光蛋白选择的影响?
A:若使用病毒、质粒或其他载体用于细胞或动物的转染/感染来研究基因/蛋白的功能影响时,载体携带了荧光蛋白,则二抗荧光选择时或载体荧光蛋白选择时,荧光蛋白和二抗携带荧光素的激发波长和发射波长应互相不能干扰,防止影响正确的荧光结果的观察。
Q2:显微镜下观察,免疫荧光信号较弱?
A:若显微镜下观察荧光信号较弱,需要考虑:1. 靶标蛋白丰度低:提高靶标蛋白的表达量;2. 固定方法不当:多聚甲醛和蛋白的氨基可以通过共价键结合,进而遮盖抗原表位,导致靶表位信号减弱,造成假阴性的结果,建议优化抗原修复或固定的方法及步骤;3. 通透方法不当:通透剂会破坏细胞膜结构,细胞膜蛋白不建议通透;4. 一抗影响:提高一抗浓度,优化一抗孵育步骤或选择更特异的一抗产品;5. 二抗影响:提高二抗浓度,优化二抗孵育步骤或选择更明亮的荧光基团;6. 信号放大不够:可以使用Invitrogen SuperBoost酪胺信号放大技术,进一步增强信号;7. 荧光淬灭:减少检测照明强度和时间并选用抗荧光淬灭封片剂封片。
Q3:在显微镜下观察荧光图像时,背景过高?
A:若显微镜下观察背景过高,需要考虑:1. 自发荧光的影响:可以设置自发荧光对照,确定是否来自样品的自发荧光,若来源于固定剂共价结合导致的自发荧光,可用NaBH4去除并增加固定剂的漂洗次数,若来自样品的自发荧光,可能需要更换样品;2. 封闭不足:可以更换封闭液或加强封闭时间;3. 一抗影响:可以减少一抗的浓度;4. 二抗影响:设置无一抗的对照,确认背景是否来源于二抗,还可以降低二抗浓度,或使用高交叉吸附的Alexa Fluor Plus二抗,信噪比比Alexa Fluor提高4-5倍;5. 组织切片预处理不当:尤其是石蜡切片脱蜡要彻底,漂洗环节和抗体孵育环节也要避免干片现象的出现。
Q4:免疫荧光实验怎么避免非特异性染色结果?
A:可以前期加强封闭和洗涤的次数和时间;若一抗不特异需要更换一抗产品,若一抗浓度过高,需要降低其浓度;也可以更换更特异的二抗。
至此,本期的干货分享内容就结束了,本期主要介绍了“功能实验干货丨免疫荧光实验”的定义、原理、实验步骤、技术应用及实验常见问题解析等,希望对想要借助免疫荧光技术开展研究的小伙伴们有所帮助。汉恒生物可以提供基因表达载体构建相关的服务,并拥有专业的技术服务团队为您答疑解惑,有意向的小伙伴欢迎与我们联系~~~,下期我们将继续为大家介绍细胞增殖及细胞凋亡相关的干货内容,小伙伴们继续关注哦~~~,敬请期待。
参考文献:
[1] Im K, Mareninov S, Diaz MFP, Yong WH. An Introduction to Performing Immunofluorescence Staining. Methods Mol Biol. 2019; 1897: 299-311.
[2] Sun H, Li H, Yan J, et al. Loss of CLDN5 in podocytes deregulates WIF1 to activate WNT signaling and contributes to kidney disease. Nat Commun. 2022 Mar 24; 13(1): 1600.
[3] Thul PJ, Åkesson L, Wiking M, et al. A subcellular map of the human proteome. Science. 2017 May 26; 356(6340): eaal3321.
[4] Zhao J, Chen AX, Gartrell RD, et al. Immune and genomic correlates of response to anti-PD-1 immunotherapy in glioblastoma. Nat Med. 2019 Mar;25(3):462-469. Epub 2019 Feb 11. Erratum in: Nat Med. 2019 Jun; 25(6): 1022.

查看更多

查看更多

查看更多

联系我们

返回顶部