查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
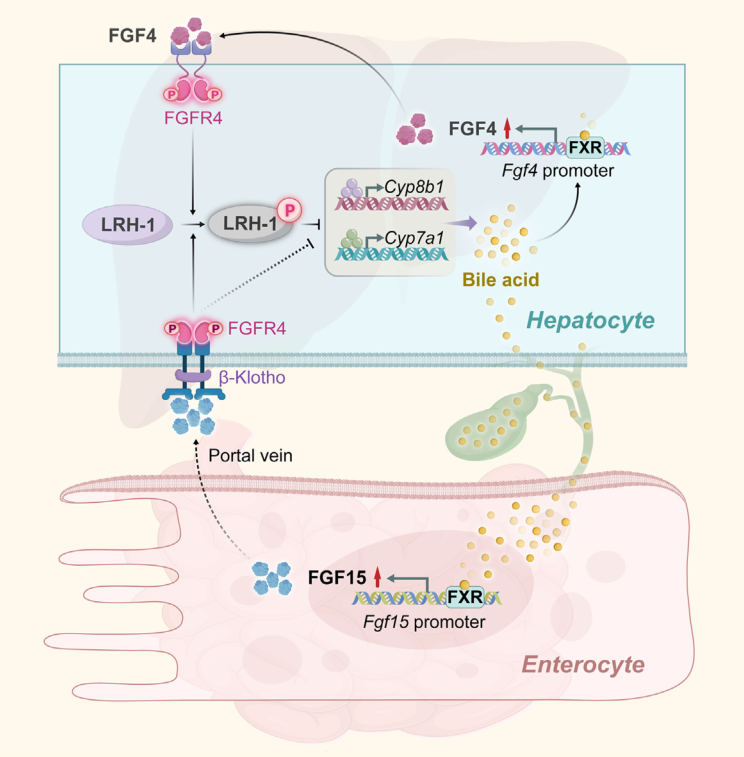
胆汁酸(BAs)在脂溶性营养素的消化与吸收过程中扮演着关键角色,并作为信号分子参与调节机体的代谢平衡和能量稳态。胆汁酸稳态一旦失衡或其信号传导途径受到干扰,可能会引发胆汁淤积、肝胆损伤以及代谢性疾病。胆汁酸合成的精细调控主要依赖于肝脏和肠道中法尼酯X受体(FXR, NR1H4)的活化,该受体能够感应胆汁酸水平的变化,并调控一系列与胆汁酸合成、转化、转运和信号传递相关的基因表达。

以往的研究发现,在餐后肠内胆汁酸增加的情况下,激活的FXR可促进肝脏中小异二聚体伴侣(small heterodimer partner,SHP)、v-maf鸡肌腱神经纤维肉瘤癌基因同源物G(v-maf avian musculoaponeurotic fibrosarcoma oncogene homolog G,MAFG)以及回肠中成纤维细胞生长因子15/19 (fibroblast growth factor 15,FGF15/19)的转录。肠道分泌的FGF15/19选择性地结合并激活肝成纤维细胞生长因子受体4(FGFR4)-β-klotho(KLB)复合体,并以尚未解析的信号路径抑制胆汁酸关键合成酶基因Cyp7a1和Cyp8b1的转录。这种内分泌途径与食物消化的生理反应相结合,在餐后阻止新的胆汁酸合成,是防止过量胆汁酸对肝脏和肠道系统产生潜在毒性的必要生理需求。由于回肠与肝脏分离,而肝脏是胆汁酸合成的主要器官,因此,回肠FGF15/19通路的功能滞后于肝脏在早期餐后胆汁酸合成中的作用。这种时空限制提出了一个关键问题:当内分泌FGF15/19信号通路尚未发挥作用时,肝内胆汁酸合成以及总胆汁酸含量是如何在肝脏中受到控制的?
2024年10月10日,温州医科大学李校堃院士团队黄志锋/宋林涛课题组,在国际代谢领域顶级学术期刊Cell Metabolism(IF=27.7)在线发表题为“Hepatic FXR-FGF4 is required for bile acid homeostasis via a FGFR4-LRH-1 signal node under cholestatic stress”的研究成果,本研究发现FGF15敲除小鼠在激活FXR后仍然可以维持对Cyp8b1表达的抑制,但无法抑制Cyp7a1,而这种抑制作用在其受体FGFR4缺乏时完全丧失。而另一个基因FGF4作为肝FXR的信号介质,可以抑制Cyp7a1和Cyp8b1的转录,进而抑制肝脏胆汁酸合成,改善胆汁淤积症,进而发现了一个新的胆汁酸合成调控通路——FGF4-FGFR4-LRH-1,当 FGF4 激活 FGFR4 后,会诱导LRH-1的磷酸化,并抑制 Cyp7a1 和 Cyp8b1 基因转录进而抑制胆汁酸合成。胆汁酸合成的精确时空控制对于在响应多种生理需求和病理挑战时维持胆汁酸稳态至关重要。这一通路的阐明,为肝脏胆汁酸合成和肠肝或全身胆汁酸稳态调控提供了新的机制见解,也为设计胆汁淤积和相关疾病的治疗新策略开启了一扇新的大门。值得注意的是,在动物实验中,使用了汉恒生物提供的腺相关病毒AAV2/9搭配肝脏特异性启动子TBG成功在小鼠肝脏中实现了重组酶cre、小鼠Lrh-1、Lrh-1-3YF、Shp基因的过表达及Shp及Fgf4基因的敲低。
下面,我们一起来了解具体的研究内容:
肝脏FGF4是与肝脏FXR和FGFR4相关的BA合成的潜在调节因子
FXR是BA稳态的中心调控因子,目前已知的一个通路是FXR通过激活小鼠肠道FGF15(人是FGF19)的转录来发挥调控作用。作为一种肠源性激素,FGF15由肠道细胞分泌后作用于肝细胞的FGFR4,进而抑制Cyp7a1和Cyp8b1的表达,从而调节餐后BA稳态。以往研究发现Fgf15-/- 小鼠具有更高水平的Cyp7a1 和 Cyp8b1,使用FXR激活剂(GW4064和CA)能对Fgf15-/- 小鼠的Cyp8b1、Cyp27a1和Cyp7b1的表达产生抑制,而不影响Cyp7a1的表达。这些结果说明在FGF15外,还有其他FXR相关因子调控Cyp8b1的表达。而Fgfr4-/-小鼠中FRX激动剂失去了对Cyp7a1 和 Cyp8b1表达的抑制作用,这表明,Cyp8b1的肝脏表达依赖于FXR和FGFR4,但不特异性地依赖于肠道FGF15,而肝脏Cyp7a1则由FXR-FGF15-FGFR4控制。鉴于这些发现,作者假设可能存在另一种与之平行的FGF15且有FXR和FGFR4参与的信号通路,调控Cyp8b1和BA的生成。
对所有FGF家族成员进行RT-qPCR、RNAscope和免疫荧光(IF)分析显示,FXR激活后,肝脏和肠道中FGF4的表达均显著增加。考虑到FGF4是FGFR4的同源配体之一,作者猜测,FGF4是除了肠道FGF15之外的FXR潜在下游靶点,可能激活肝脏FGFR4并抑制肝脏Cyp7a1和Cyp8b1的表达来参与BA的调控。
为了明确FGF4在BA的关系,作者构建了肝脏特异缺失FGF4的小鼠FGF4 - LKO和在肠道特异缺失FGF4的小鼠FGF4 - IKO。与FGF4f/f (WT)小鼠相比,肝脏缺失FGF4后Cyp7a1和Cyp8b1的表达水平更高,而且还消除了FXR激活(GW4064或CA处理)对Cyp8b1表达的抑制作用,在较小程度上抑制了Cyp7a1的表达,但没有抑制Cyp27a1和Cyp7b1的表达。另一方面肠道缺失FGF4后Cyp8b1、Cyp7a1、Cyp27a1和Cyp7b1的表达水平不受FXR活性影响。使用AAV在FGF4 - LKO小鼠上过表达FGF4后能恢复FXR对Cyp8b1的抑制作用。使用AAV2/9-TBG-shRNA-m-Fgf4敲低Fgf15-/- 小鼠的FGF4能抑制FXR对Cyp8b1的抑制功能,但是Cyp7a1的抑制现象不受影响。在BA的合成途径中Cyp8b1处于CYP7A1调控的下游,肝内FGF4参与FXR对CYP8B1在肝脏表达控制,作者推测这可能是对肠源性FGF15调控肝脏CYP7A1和CYP8B1进而影响BA合成的重要补充。
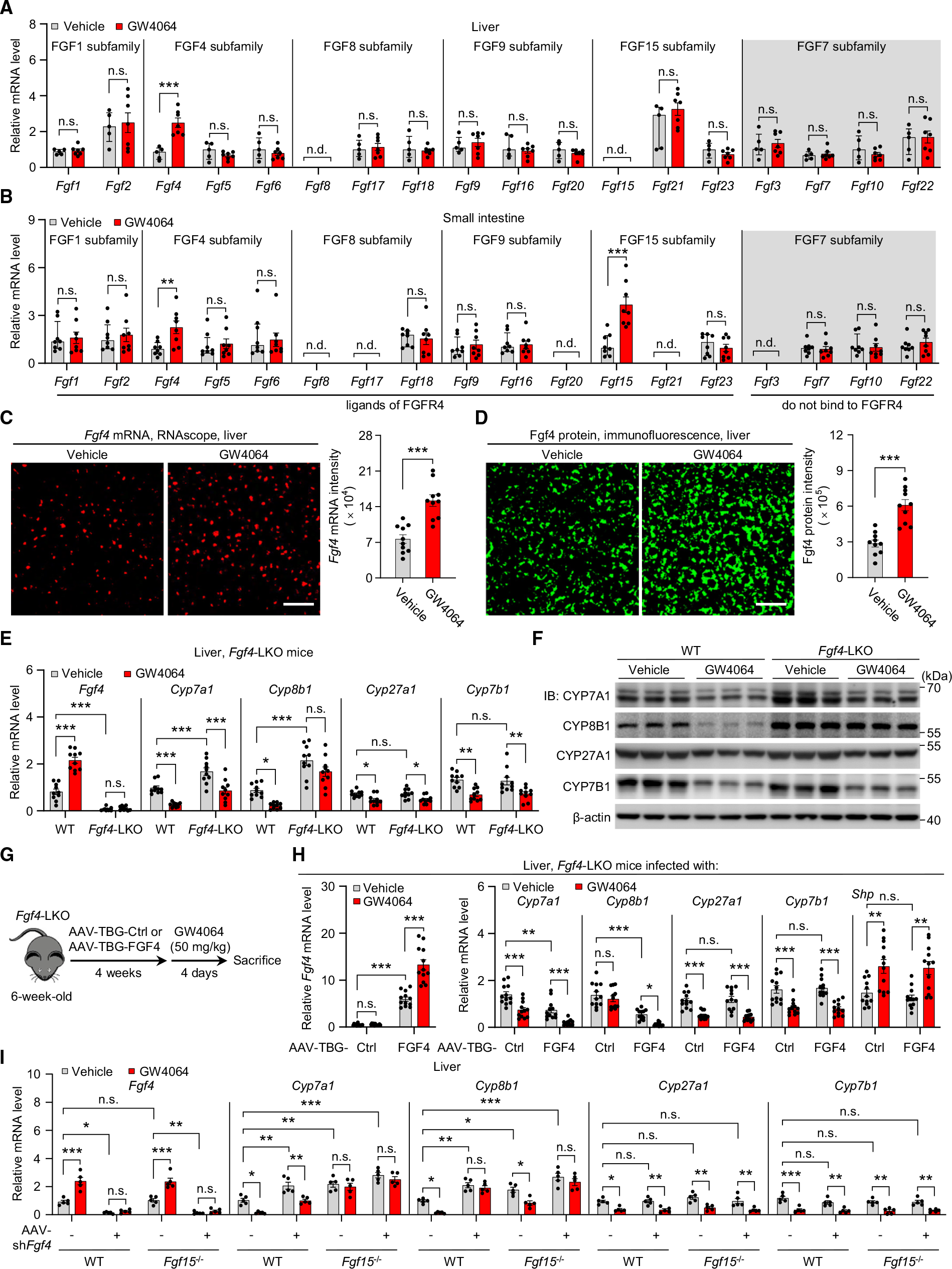
图1. 肝脏中FGF4的表达上调通过FXR来抑制BA合成
FGF4是FXR下游调控的直接靶点
为搞清楚FXR如何调节肝脏FGF4的表达,作者首先确认FXR是否直接控制的FGF4转录。在FGF4基因的近端启动子区,发现了序列为AGGGCAATGATCT的FXR响应单元(FXRE),将其构建到双荧光素酶报告载体上,通过双荧光素酶报告分析显示FXR可通过FXRE序列调控报告基因表达,ChIP-seq结果也显示FXR能结合到FGF4的FXRE附近位置。动物实验结果显示FRX的缺失能抑制FXR激动剂对FGF4的上调作用。以上研究结果说明FXR能作为转录因子直接调控FGF4的表达,
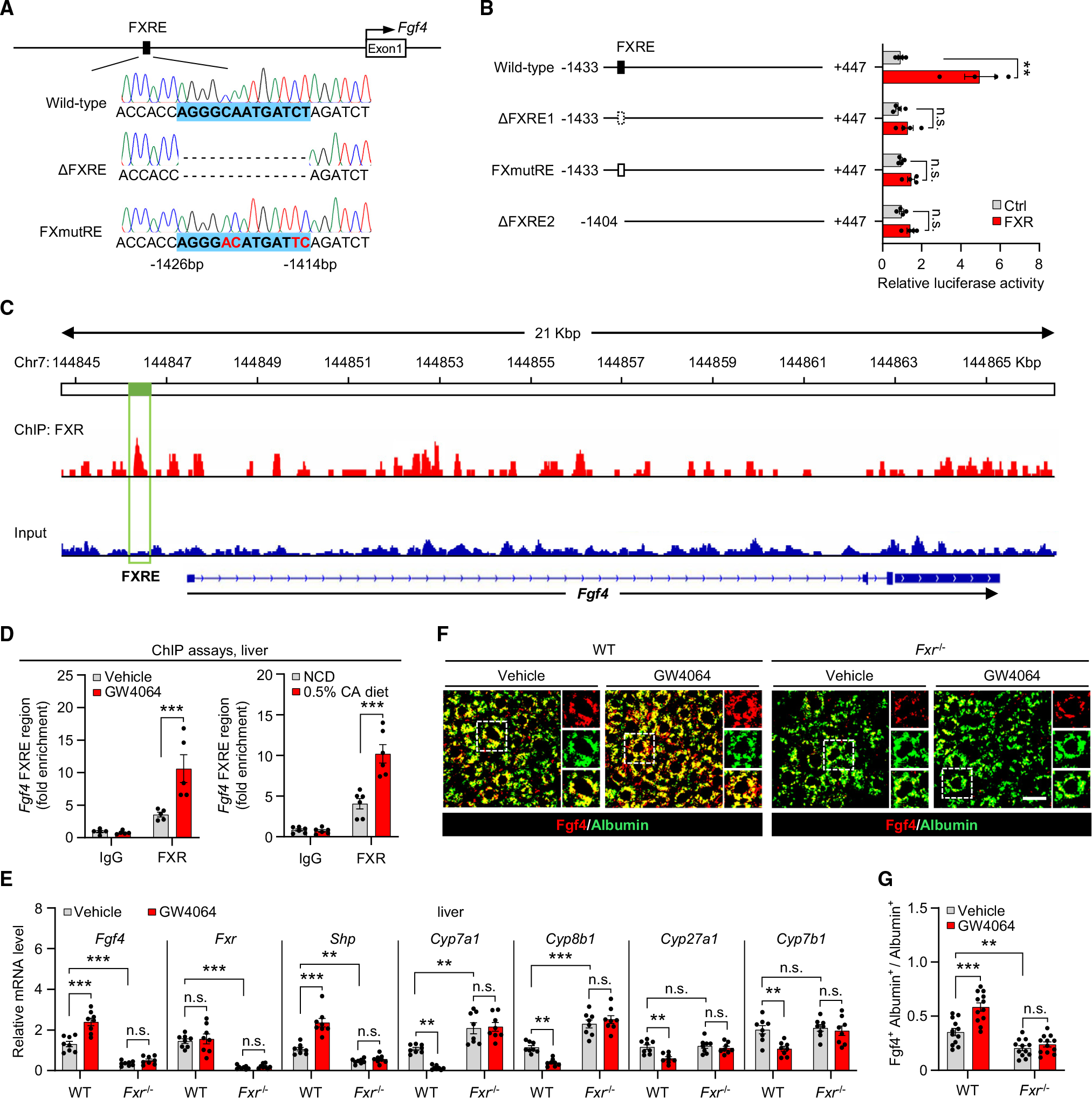
图2. FGF4是FXR的下游调控的直接靶点
肝脏特异性缺失FGF4会加剧胆汁淤积和肝损伤
那么FGF4的异常是否和胆汁淤积及肝损伤相关?作者对患者和小鼠模型(ANIT诱导)的样本展开研究,发现胆汁郁积的状态下,FXR-FGF4信号轴的活性会减弱。此外,FGF4缺陷小鼠在ANIT作用下表现出严重的肝损伤,包括血清谷丙转氨酶(ALT)和天冬氨酸转氨酶(AST)水平显著高于WT小鼠,Cyp7a1和Cyp8b1水平升高,肝脏、肠道和胆囊BA含量升高以及血清总胆红素升高等指标。为了进一步证实FGF4在控制BA稳态和胆汁淤存病理中的作用,作者构建了Mdr2和肝FGF4双敲除小鼠(Mdr2-/-;FGF4-LKO)。MDR2突变是人类进行性家族性肝内胆汁淤积症发生的原因,作者发现和野生型的小鼠相比,肝脏FGF4的缺失显著加重了由Mdr2缺失引起的胆汁淤积性肝损伤和纤维化,与疾病相关的指标如 ALT和 AST升高,Cyp7a1 和 Cyp8b1表达水平上升,肝脏、血清和小肠的BA水平升高。这些结果说明在BA合成的内分泌和负反馈调节中,已知的FXR-FGF15轴在FGF4缺乏加剧的胆汁淤积性肝损伤中所起的作用并不显著,证实FGF4在控制BA稳态和胆汁淤存病理中存在调控作用。
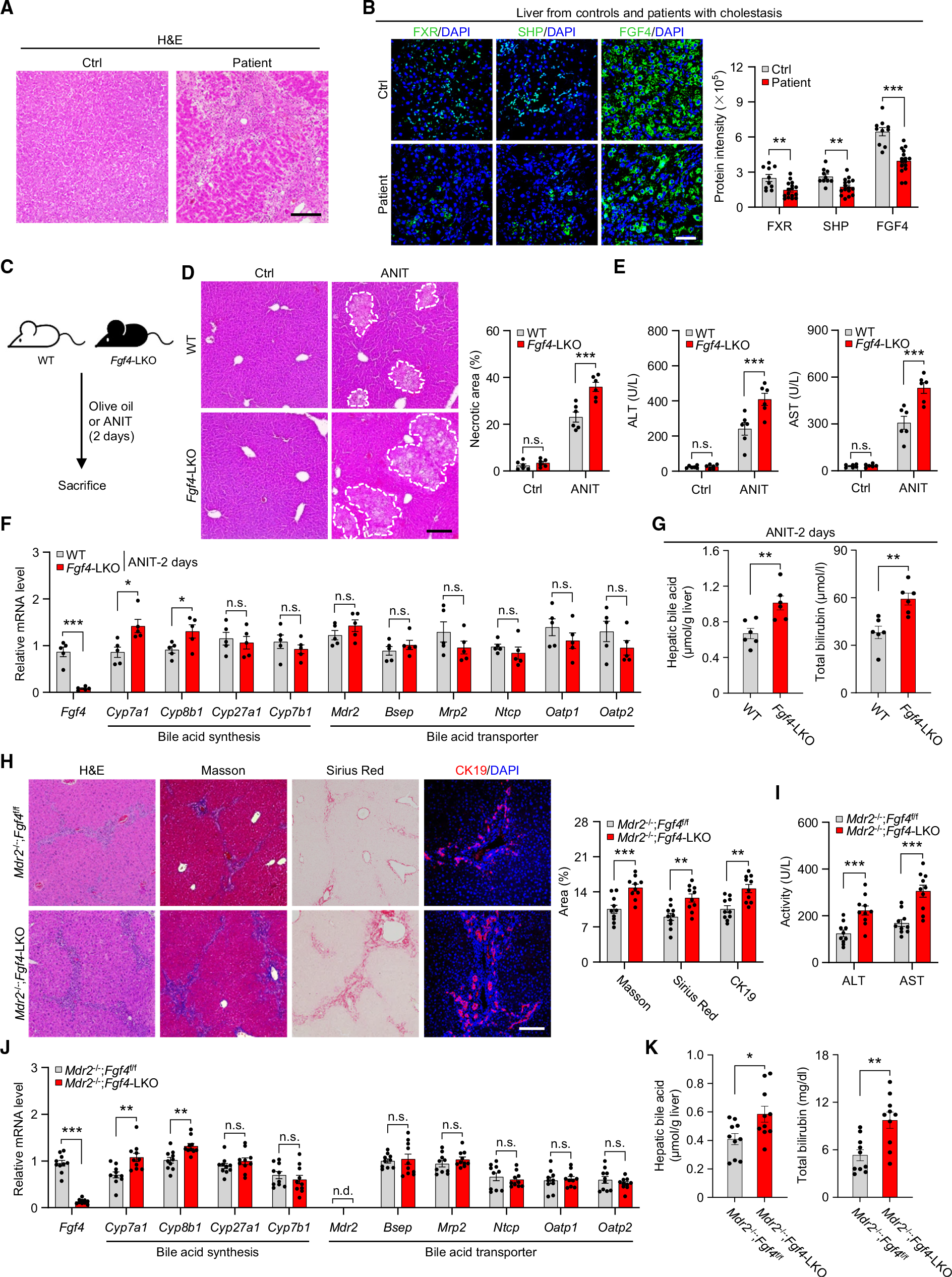
图3. 肝细胞特异性缺失FGF4导致BA合成加剧胆汁淤积性肝损伤
FGF4药物治疗通过抑制BA合成保护肝脏免受胆汁淤积性肝损伤
接下来,作者对FGF4是否是相关疾病的潜在治疗靶点咱开了研究。病例切片分析发现,与对照组相比,使用FXR激动剂(GW4064)对ANIT诱导的肝坏死具有显著的保护作用,并且肝脏FGF4表达水平显著升高,BA水平显著降低。而过表达FGF4能降低ANIT诱导的肝损伤的相关指标( ALT和 AST )。这结果表明FGF4在FXR激动剂诱导的抗胆汁淤积作用中起中介作用,FGF4在胆汁淤积和相关肝损伤方面是具有药理潜力的。此外,作者还评估了rFGF4(FGF4重组蛋白)对ANIT和Mdr2缺乏诱导的胆汁淤积模型的治疗效果。rFGF4能显著降低肝脏、血清和小肠中的BAs以及血清总胆红素,抑制了Cyp7a1 和 Cyp8b1的升高,降低ALT和AST的水平,改善了坏死面积、胆道纤维化和胆管细胞增殖等组织病理学参数。
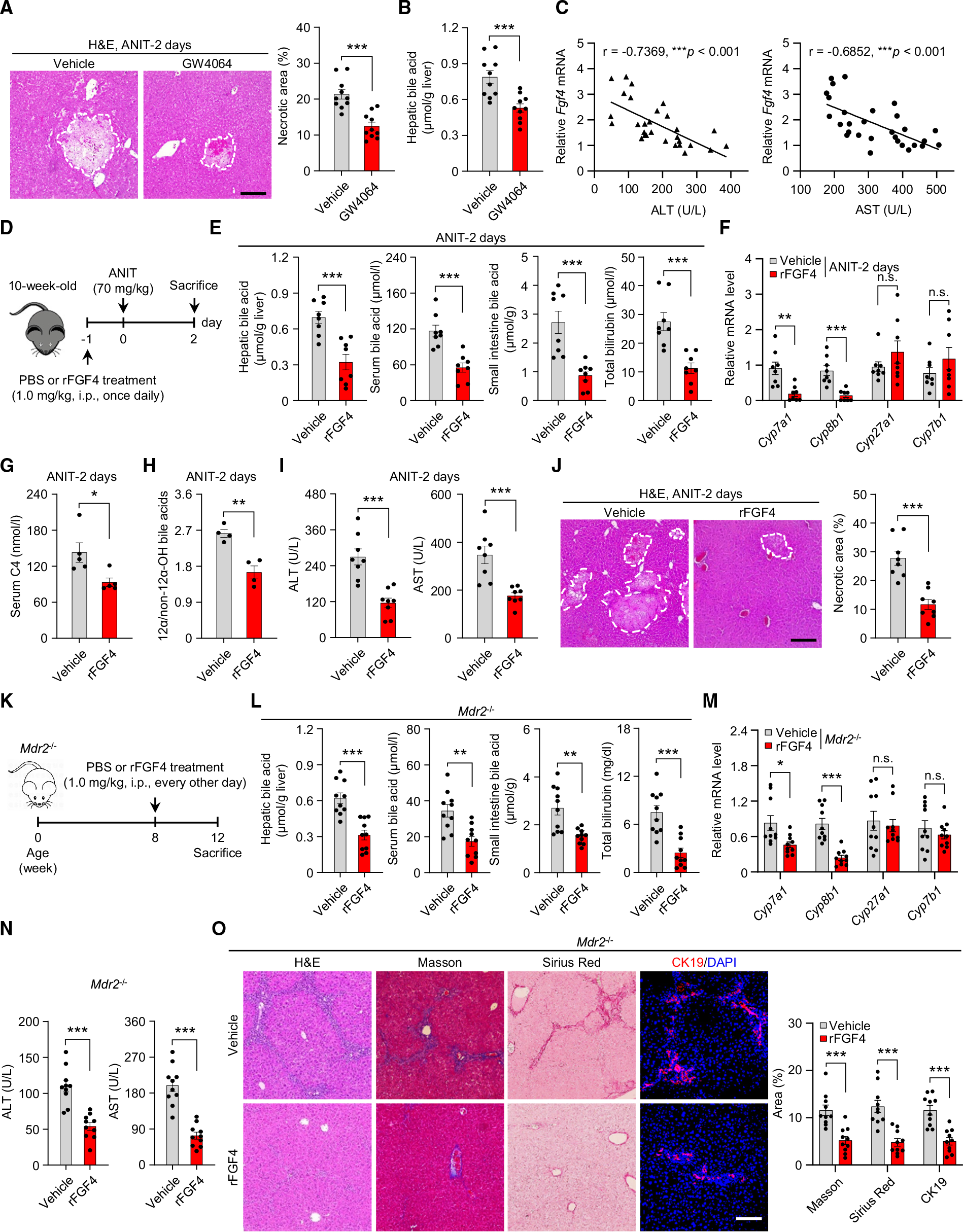
图4. FGF4抑制BA合成,保护小鼠免受胆汁淤积和肝损伤
FGF4激活肝脏FGFR4到细胞内LRH-1信号通路,控制BA合成
证实了FGF4能抑制BA的合成后,作者着力于其分子机制的探索。首先,作者把下游的目标锁定在FGF4的受体FGFR4,FGFR4也是已知的调控肝脏BA合成的受体之一。通过给小鼠注射rFGF4后能检测到肝脏的FGFR4的磷酸化水平显著上调,而敲除FGFR4能抑制rFGF4对Cyp7a1 和Cyp8b1的抑制作用。关于FGFR4下游通路的研究,作者参考以往的研究并结合pull down实验,发现SHP, MAFG,LRH-1和 HNF4α与FGFR4有直接相互作用,但是只有LRH-1是已知的和Cyp7a1 、 Cyp8b1调控相关,实验也证明了LRH-1能被FGFR4磷酸化,rFGF4能显著促进野生型小鼠LRH-1磷酸化水平,但是不影响FGFR4敲除的小鼠的LRH-1磷酸化水平。因此LRH-1很有可能是FGFR4调控的下游基因。
之前研究表明LRH-1在肝脏发挥转录因子作用,并调控Cyp7a1 和Cyp8b1的转录。作者发现Cyp7a1 和Cyp8b1的启动子区域存在LRH-1的响应元件(Lrh1RE),猜测LRH-1可能会作为转录因子直接调控Cyp7a1 和Cyp8b1的转录。通过双荧光素酶实验验证LRH-1对Cyp7a1 和Cyp8b1的转录调控,结果显示过表达LRH-1能显著上调报告基因的表达,但是突变Lrh1RE后LRH-1激活转录作用消失,说明LRH-1能作为转录因子上调Cyp7a1 和Cyp8b1的转录。但是当FGFR4存在时,rFGF4能抑制LRH-1的功能,缺乏FGFR4时,rFGF4就失去了作用LRH-1的功能,报告基因水平上调。同样,肝脏特异敲除LRH-1的小鼠也能观察到Cyp7a1 和Cyp8b1表达的下调和rFGF4调控作用的失效。因此能推测出FGF4-FGFR4-LRH-1-Cyp7a1/Cyp8b1通路调控BA的合成。
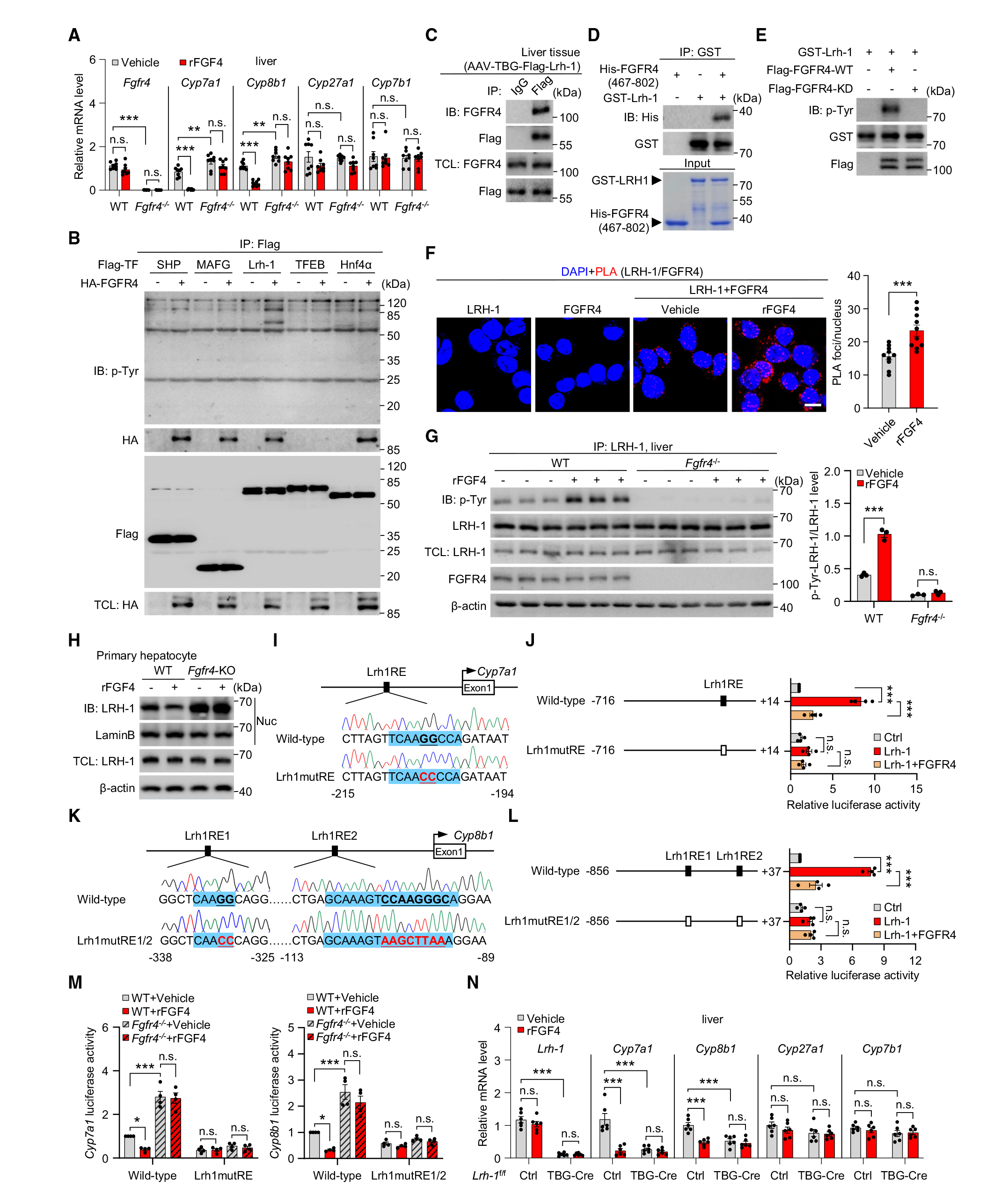
图5. FGF4激活肝脏FGFR4-LRH-1信号通路,控制BA合成
在BA合成调控过程中,LRH-1磷酸化起到了关键作用
为了进一步了解LRH-1的作用机制,研究团队通过诱变分析和体外激酶试验研究其潜在的磷酸化位点,结果显示LRH-1的三个酪氨酸(Tyr292, Tyr296和Tyr547)是FGFR4的催化磷酸化的位点,将这三个位点突变为苯丙氨酸(3YF)或者其他氨基酸后(如谷氨酸和天冬氨酸)后能抑制rFGF/FGFR对LRH-1的磷酸化,降低LRH-1在细胞核的定位,抑制对Cyp7a1/Cyp8b1表达的下调效果。同样在动物实验中,LRH-1(3YF)突变能消除对Cyp7a1/Cyp8b1的抑制作用。综上所述,这些数据表明,FGF4介导的BA合成抑制依赖于LRH-1的酪氨酸磷酸化。
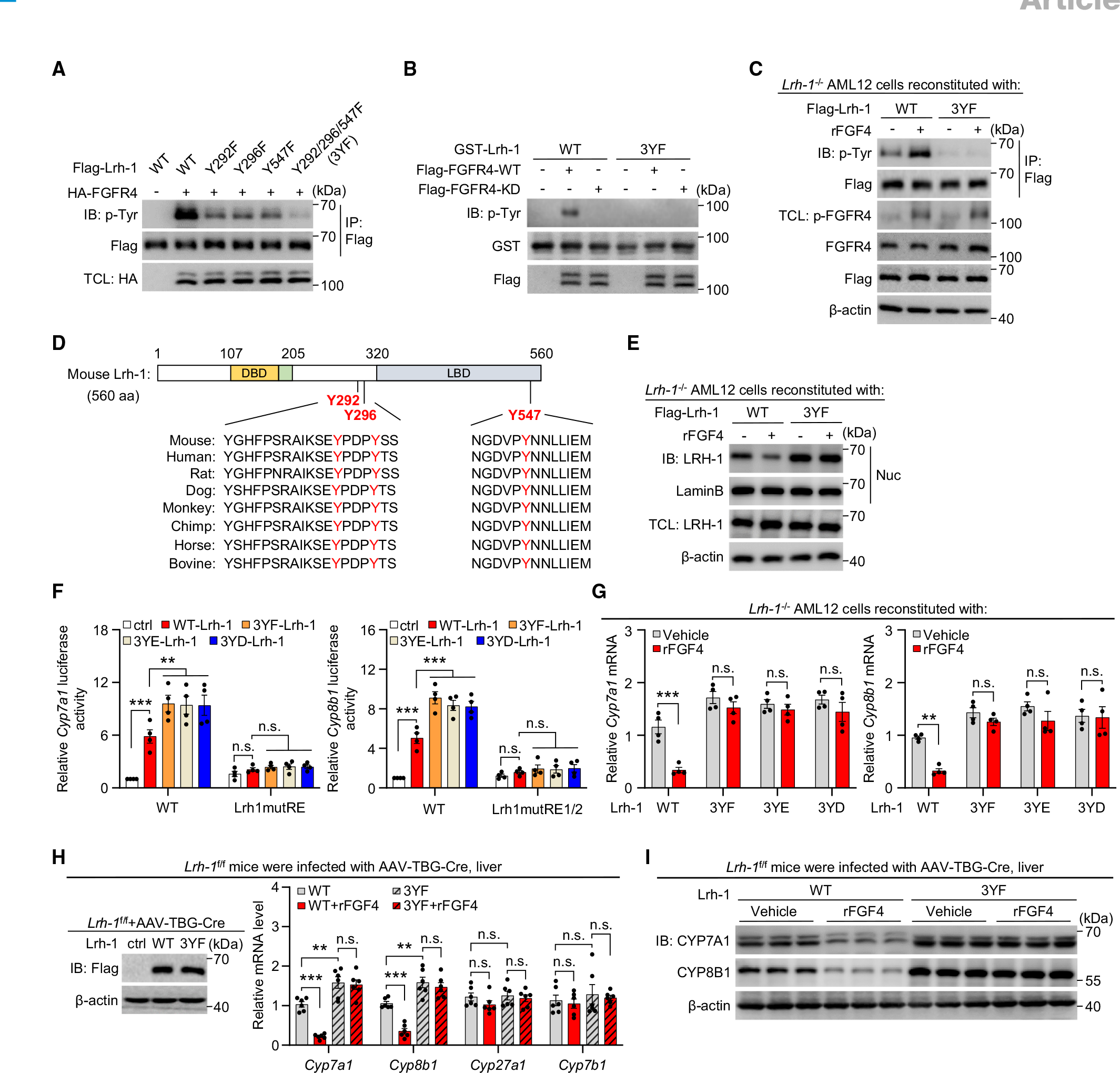
图6. LRH-1通过磷酸化激活参与FGF4-FGFR4-LRH-1途径介导的BA合成抑制
FGF4-FGFR4-LRH-1保护肝脏免受胆汁淤积性损伤
为了明确FGF4-FGFR4-LRH-1在BA稳态中的意义,作者使用AAV2/9结合TBG启动子在LRH-1敲除鼠肝脏分别特异性过表达WT-LRH-1或者 3YF-LRH-1,并用ANIT诱导小鼠胆汁淤积,观察FGF4-FGFR4-LRH-1对疾病的影响。与WT-LRH-1相比,3YF突变组胆汁淤积性肝脏病变更为严重。相比之下,rFGF4对ANIT诱导的胆汁淤积病变、血清ALT、AST和总胆红素水平以及肝脏、血清、小肠和胆囊中的BA池的改善被3YF突变体的表达所消除。同样,rFGF4诱导的Cyp7a1和Cyp8b1的下调也被3YF消除。这些结果突显了LRH-1磷酸化的重要作用,FGF4-FGFR4-LRH-1通路在肝脏起着调控BA合成的作用以及影响肝脏的适应性,起到了防御胆汁淤积的作用。
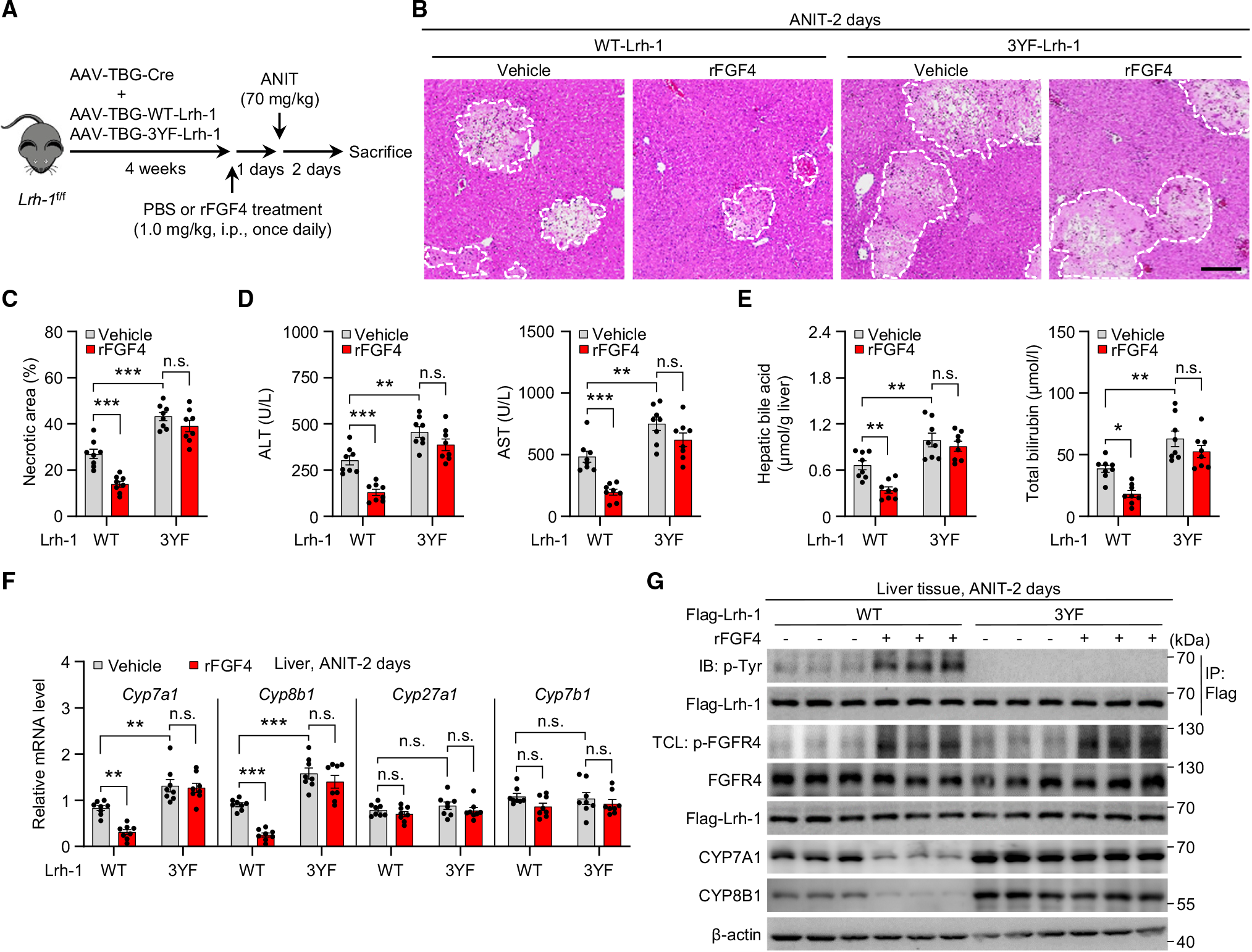
图7. FGFR4介导的LRH-1磷酸化对胆汁淤积性肝损伤的治疗效果
总之,本研究揭示了肝脏FGF4作为FXR下游的一种新的调控肝脏中胆汁酸的合成通路。FGF4信号通过FGFR4和LRH-1这一通路精确调控胆汁酸的合成对于维持胆汁酸稳态、减少其在肝胆和肠道系统中的毒性至关重要,这有助于应对各种生理需求和疾病的改善。肝FGF4-FGFR4-LRH-1通路发现,为人类揭示了胆汁酸稳态的额外的控制机制。这一发现不仅深化了对胆汁酸合成和全身胆汁酸稳态调控机制的理解,而且对于开发针对胆汁淤积及其相关肝病的潜在药物治疗策略具有重要的战略指导意义。

查看更多

查看更多

查看更多

联系我们

返回顶部