查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
代谢是一种编码生物信息的化学语言,与炎症反应具有极强的相关性。代谢物可以作为启动生理适应的信号传导方式,例如,细胞溶质pH可调节巨噬细胞炎症反应。巨噬细胞可自发或相应动态刺激改变其理化性质,这对于炎症期间的组织稳态至关重要,也是探索新型抗炎策略的一个有前途的重点。然而,代谢物引发的信号通路在对巨噬细胞响应刺激的反应中的作用仍未完全表征。

第三军医大学西南医院唐康来、郭林、陈玉佳男、第三军医大学缪洪明、纽约大学刘传聚共同通讯在《Signal Transduction And Targeted Therapy》(IF:40.8)发表研究论文《Malate initiates a proton-sensing pathway essential for pH regulation of inflammation》,证明了TCA循环中间体L-苹果酸直接结合结合免疫球蛋白(BiP),抑制了BiP与干扰素调节因子2结合蛋白2(IRF2BP2)的相互作用,保护IRF2BP2受BiP驱动的降解,在体外和体内抑制炎症反应。pH降低促进L-苹果酸羧基质子化,促进L-苹果酸和羧酸类似物结合BiP,并以羧基依赖的方式抑制BiP-IRF2BP2相互作用。在巨噬细胞中,BiP-IRF2BP2信号通路对pH值变化敏感,可介导抗酸化炎症以及细胞内pH碱化剂诱导的促炎作用。此外小鼠结肠中的局部碱化以骨髓BiP依赖的方式诱导结肠炎,并降低降低IRF2BP2的蛋白质水平。
在本文中,作者使用了汉恒生物提供的HBLV-U6-gRNA-EF1-CAS9-PURO慢病毒载体,敲除Raw264.7细胞中的Hspa5和Mdh2基因构建了Hspa5+/-和Mdh2-/-细胞系。

首先,作者通过脂多糖(LPS)刺激的骨髓衍生巨噬细胞(BMDM)模型筛选了38种可溶解的能量代谢中间体,通过qPCR检测各代谢物处理组的炎症因子Il1b、Tnf和Il6表达水平,发现L-苹果酸具有最显著的抗炎症作用。通过ELISA验证L-苹果酸对IL-6和TNF-α的抑制作用,wb证实L-苹果酸可抑制IL-1β前体(pro-IL-1β)的表达。另一方面,为了检验L-苹果酸的内源性增加是否调节炎症反应,作者在Raw264.7细胞系中敲除了苹果酸脱氢酶2(Mdh2),发现Mdh2的敲除增加了细胞内苹果酸水平并减弱了LPS诱导的促炎细胞因子表达。此外,在体内实验中,L-苹果酸(200或400 mg/kg)显著提高了LPS急性炎症模型小鼠存活率;胶原抗体诱导的关节炎(CAIA)小鼠模型的爪肿胀、关节破坏、临床评分方面结果显示L-苹果酸同样减轻了疾病的严重程度。
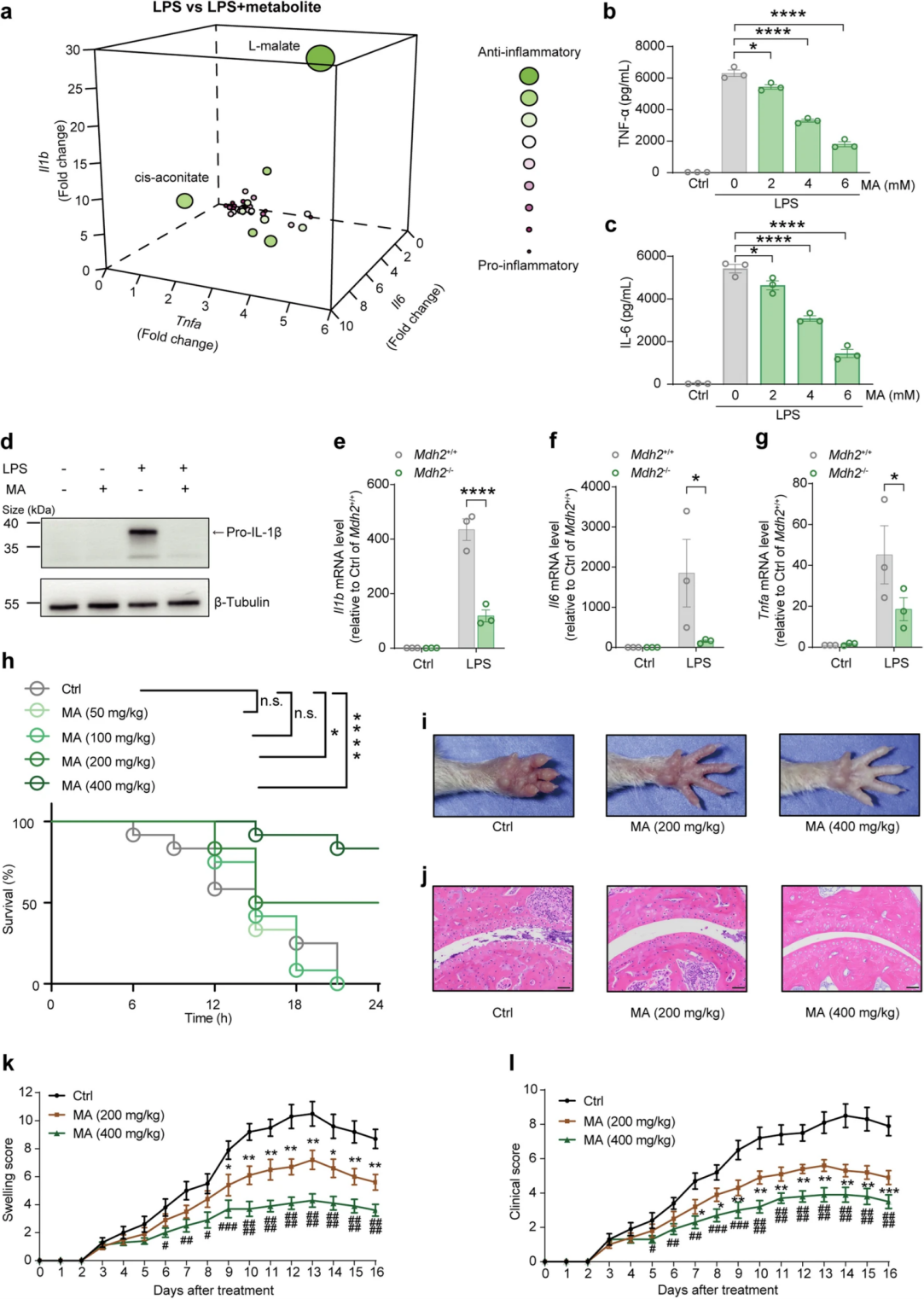
图1. L-苹果酸可在体内和体外缓解炎症反应
许多研究证明糖酵解是LPS诱导Il1b表达的必要条件,然而,前期试验结果显示L-苹果酸不影响LPS刺激的巨噬细胞糖酵解,这表明L-苹果酸抑制炎症反应独立于代谢。因此,作者利用药物亲和反应靶向稳定性(DARTS)试验分析了L-苹果酸诱导抗炎作用的潜在分子基础——使用蛋白酶消化Raw264.7细胞,通过考马斯亮蓝检测法、质谱分析和Western blot鉴定到消化过程中受L-苹果酸处理保护的蛋白中存在显著富集的结合免疫球蛋白(BiP,又称Grp78、HspA5)。表面等离子共振(SPR)检测到L-苹果酸与重组BiP蛋白或细胞内源的无信号肽全长BiP可直接相互作用。在活化的BMDM中,BiP缺乏可在LPS刺激后期大幅下调pro-IL-1β,并阻断直接添加L-苹果酸和在pHe(胞外pH)控制条件下添加L-苹果酸(培养基pH6.9)对Il1b水平的抑制作用。此外,在LPS致死小鼠模型中,L-苹果酸诱导所增加的存活率被BiP骨髓特异性敲除抵消。
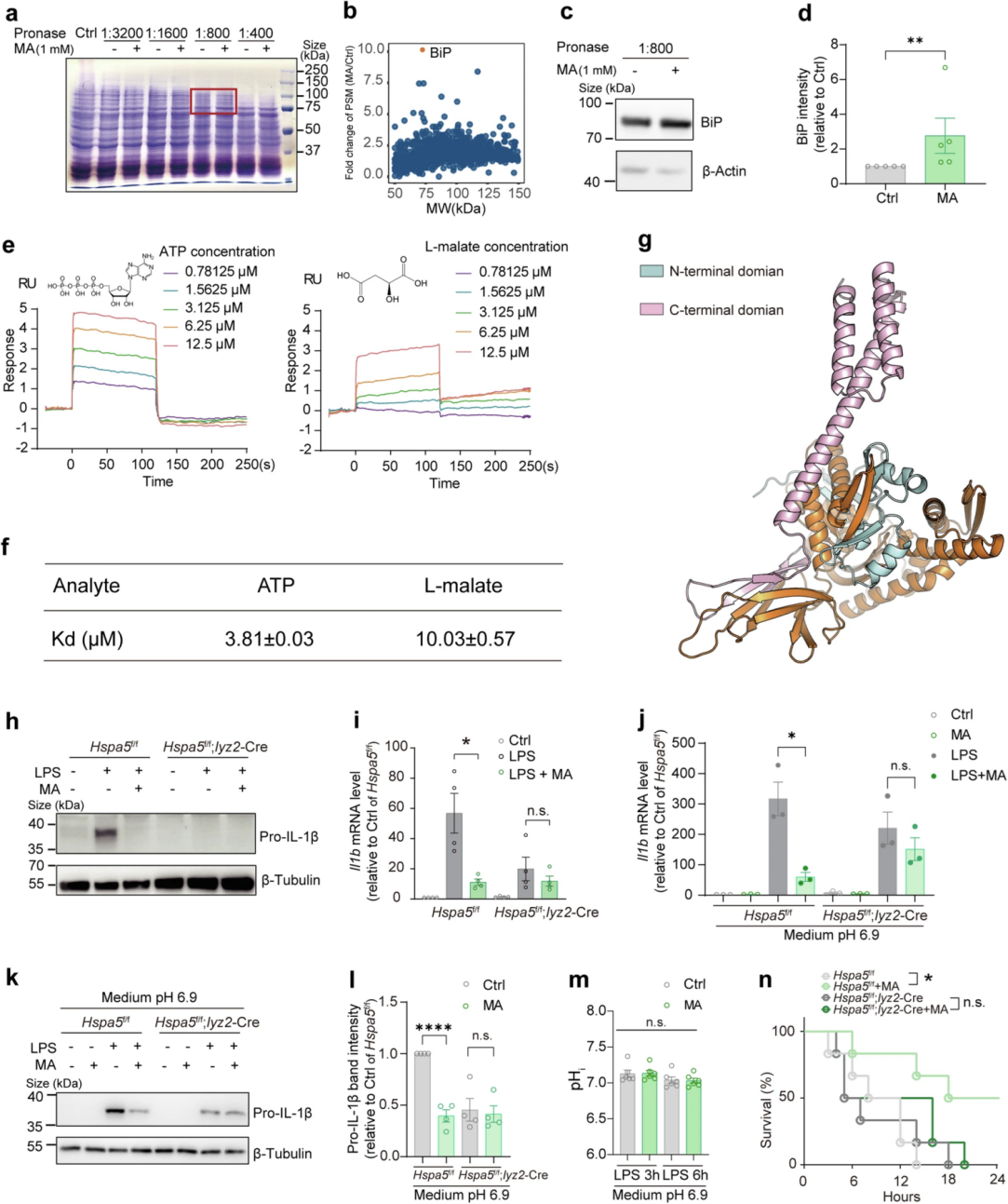
图2. L-苹果酸与BiP直接结合以实现抗炎作用
此前的研究发现,部分蛋白可与代谢物反应发生结构重排,并伴随其蛋白质复合物状态的改变,作者推测BiP与L-苹果酸的结合引起构象变化,影响其蛋白-蛋白相互作用。为了揭示炎症调节和L-苹果酸-BiP通路之间的关联,作者研究了L-苹果酸是否影响BiP与相关配体的结合。蛋白质微阵列结果显示IRF2BP2具有最强的“BiP结合信号”和最强的L-苹果酸敏感性。在L-苹果酸处理的LPS BMDM模型中,RNA-seq检测分析结果显示,地塞米松是预测到的发生转录改变的5个上游转录调控因子之一,差异表达的基因参与了“PD-1/PD-L1癌症免疫治疗通路”和“糖皮质激素受体信号转导”通路,而IRF2BP2正是一种糖皮质激素受体(GR)和NF-κ B的共同调节因子,这表明IRF2BP2可能与L-苹果酸的抗炎作用存在相关性。随后,作者通过SPR检测到BiP与IRF2BP2直接结合,L-苹果酸可阻断BiP-IRF2BP2结合,并且L-苹果酸与IRF2BP2无直接结合。近端连接测定、免疫荧光和共免疫沉淀结果显示L-苹果酸处理抑制LPS诱导的BiP-IRF2BP2相互作用,而pHe(培养基pH 6.7)或胞内pH(pHi)未显著降低。以上结果证明BiP可直接与IRF2BP2结合,而L-苹果酸可抑制BiP与IRF2BP2的相互作用。
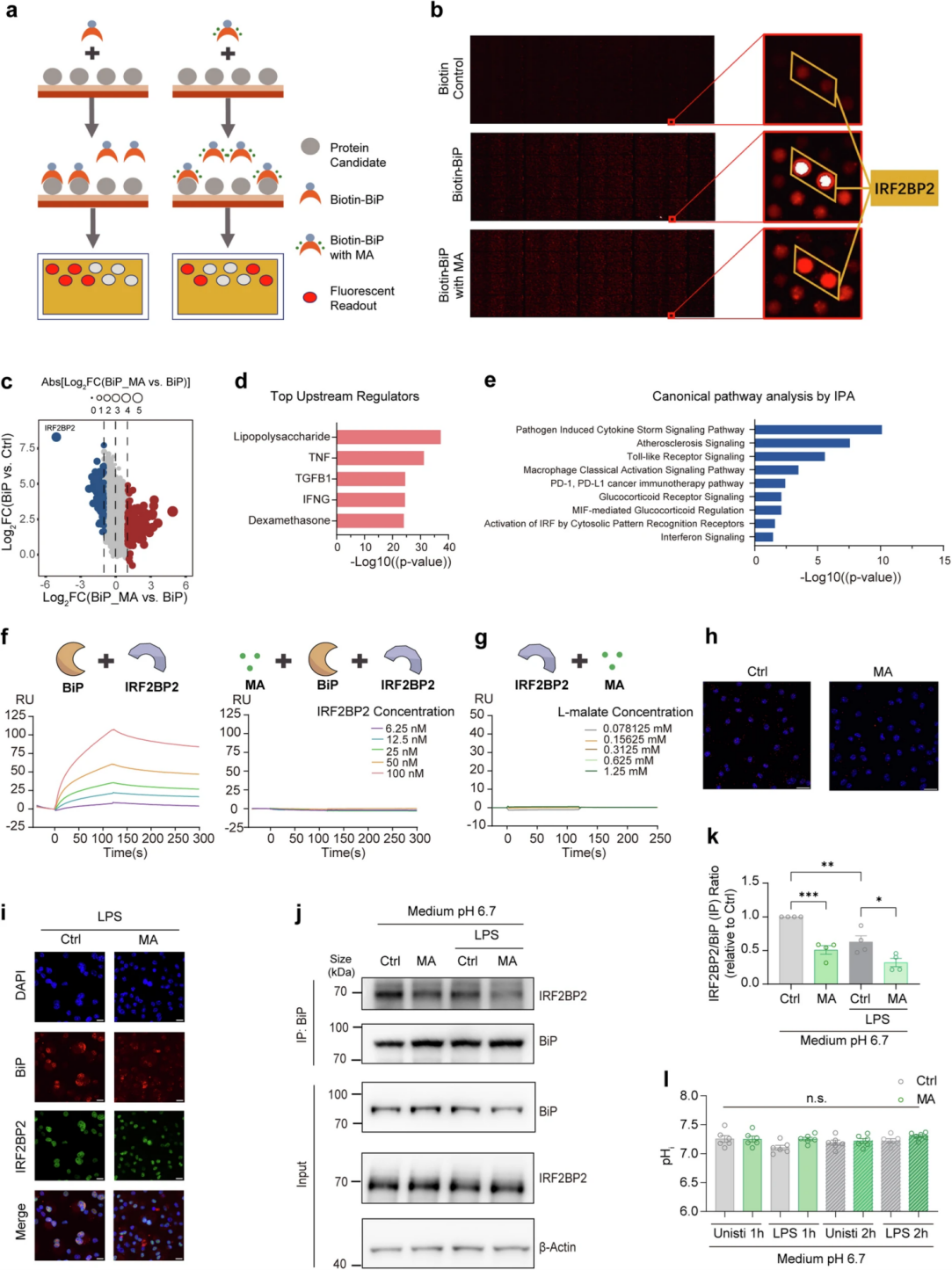
图3. L-苹果酸抑制BiP-IRF2BP2的直接相互作用
接下来,作者在BMDM中探索了IRF2BP2是否介导L-苹果酸-BiP轴对炎症反应的影响。加入L-苹果酸后,IRF2BP2蛋白水平以BiP依赖性方式增加,然而L-苹果酸并不影响LPS诱导后的Irf2bp2 mRNA水平。BiP诱导剂衣霉素Tunicamycin和毒胡萝卜素Thapsigargin可增加胞内或细胞核中的BiP蛋白水平,并以BiP依赖性方式显著降低了LPS刺激后的IRF2BP2蛋白丰度,但不影响Irf2bp2 mRNA水平。衣霉素促进了活化的BMDM中IL-1β的表达和pro-IL-1β产生,而IRF2BP2的缺乏则减弱了这种促进作用。IRF2BP2的缺乏在LPS诱导的BMDM中阻断了L-苹果酸的抗炎作用,并在体内实验中降低了小鼠存活率。这些结果表明L-苹果酸-BiP轴通过与BiP结合的IRF2BP2调节炎症反应。
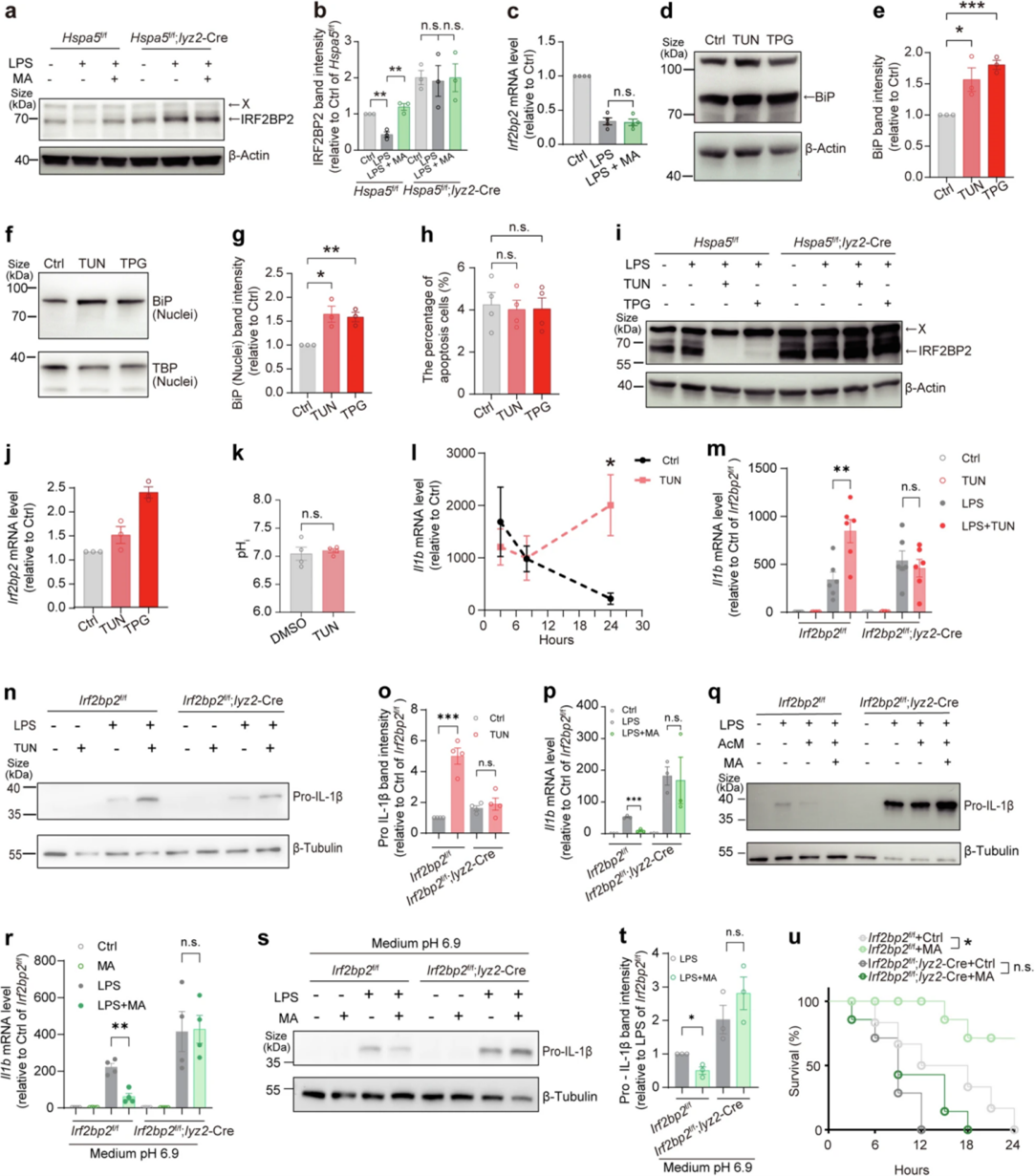
图4. L-苹果酸-BiP轴通过靶向IRF2BP2蛋白水解调节炎症反应
由于BiP和L-苹果酸不影响Irf2bp2的mRNA水平,作者推测L-苹果酸-BiP轴可能调控IRF2BP2蛋白的稳定性。WB结果显示,在蛋白质合成抑制剂环己亚胺CHX处理的BMDM中,BiP诱导剂下调了IRF2BP2蛋白表达量,即降低了稳定性。IRF2BP2蛋白的稳定性以BiP依赖的方式被BiP诱导剂破坏,并可被L-苹果酸保护。LPS处理的BMDM中,IRF2BP2蛋白水平8 h时下降,而在8至24 h后恢复,这可以解释为LPS诱导BMDM抑制了BiP-IRF2BP2相互作用。IRF2BP2的稳定性受泛素和蛋白酶体依赖性降解的调节,作者测试了泛素-蛋白酶体系统在L-苹果酸-BiP轴调节IRF2BP2和IL-1β中的作用。结果显示在LPS诱导的BMDM中,自噬体-溶酶体融合抑制剂巴佛洛霉素A不影响L-苹果酸诱导的抗炎调节作用,而使用蛋白酶体抑制剂MG132消除了L-苹果酸添加对IL-1β表达、以及对IRF2BP2蛋白丰度的影响。通过Co-IP分析,作者发现在L-苹果酸处理的BMDM以及Hspa5+/- Raw 264.7细胞中,MG132预处理可降低IRF2BP2的泛素化程度。这些研究结果表明,IRF2BP2的降解以BiP依赖性的方式接受BiP和L-苹果酸的调控。
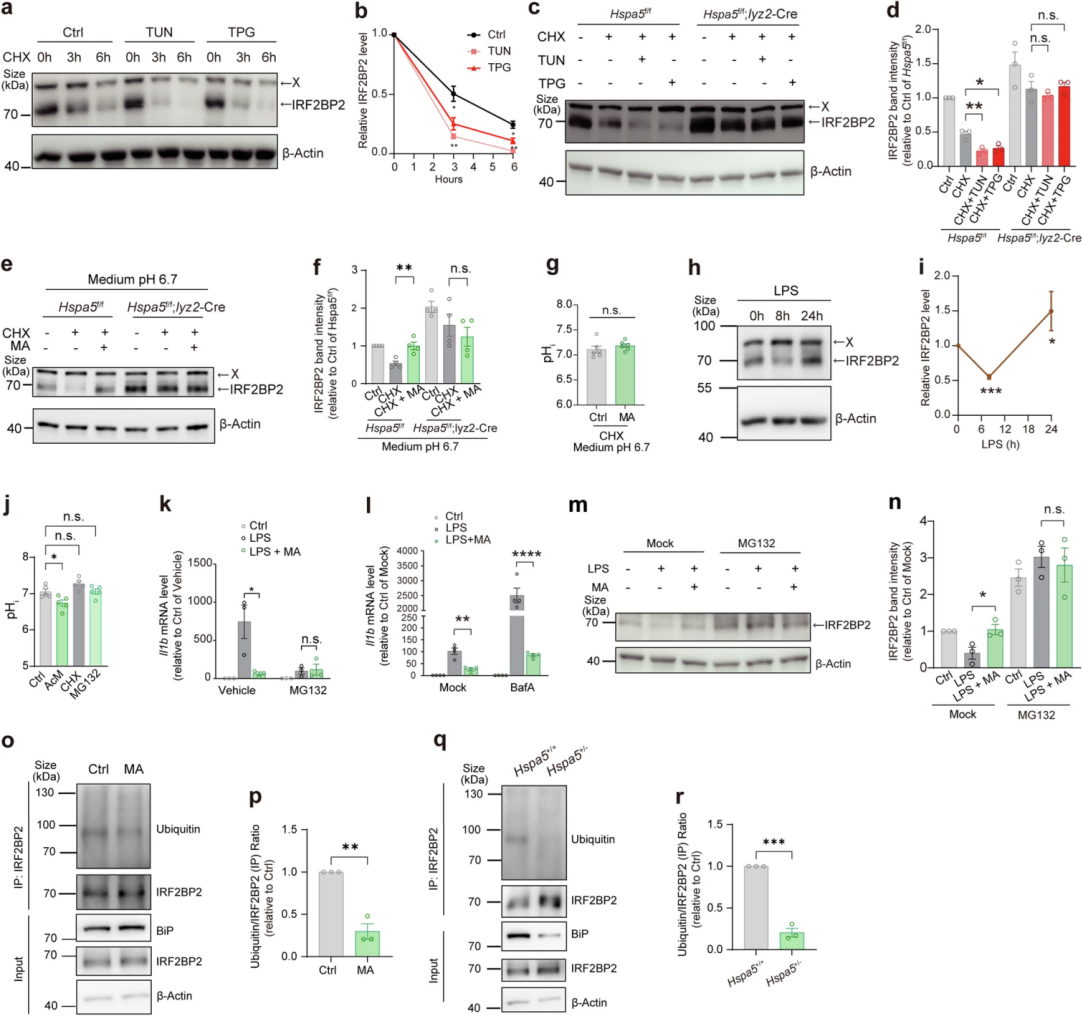
图5. L-苹果酸可保护IRF2BP2免受BiP驱动的蛋白质降解
根据前期实验,pHi变化对IL-1β产生的影响与pH对BiP-IRF2BP2通路的潜在影响具有相关性,于是,作者通过不同的pH调节剂如Nigericin、Valinomycin以及酸化剂(AcM)改变pHi,探究了pH如何影响BiP与IRF2BP2之间的信号传导。Co-IP结果显示,BiP-IRF2BP2的相互作用随着pH降低而减弱;AcM可减弱BiP-IRF2BP2相互作用、减轻IRF2BP2的降解,而在莫能菌素(驱动的潜在H+二级主动转运)处理可抑制这一作用。另一方面,pHi碱化剂NH4Cl则促进了BiP-IRF2BP2相互作用。以上数据证明了细胞质质子(H+)可通过某些途径影响BiP-IRF2BP2的相互作用。触发溶酶体释放质子的TMEM175激活剂(ArA和DB)以BiP依赖性方式保护IRF2BP2免受降解,ArA和AcM增加了LPS处理后IRF2BP2的蛋白丰度,而BiP敲除则消除了这些效应。以上结果表明,细胞质质子抑制了细胞中BiP与IRF2BP2的相互作用,并通过BiP诱导IRF2BP2的积累,该效应与溶酶体酸化无关。
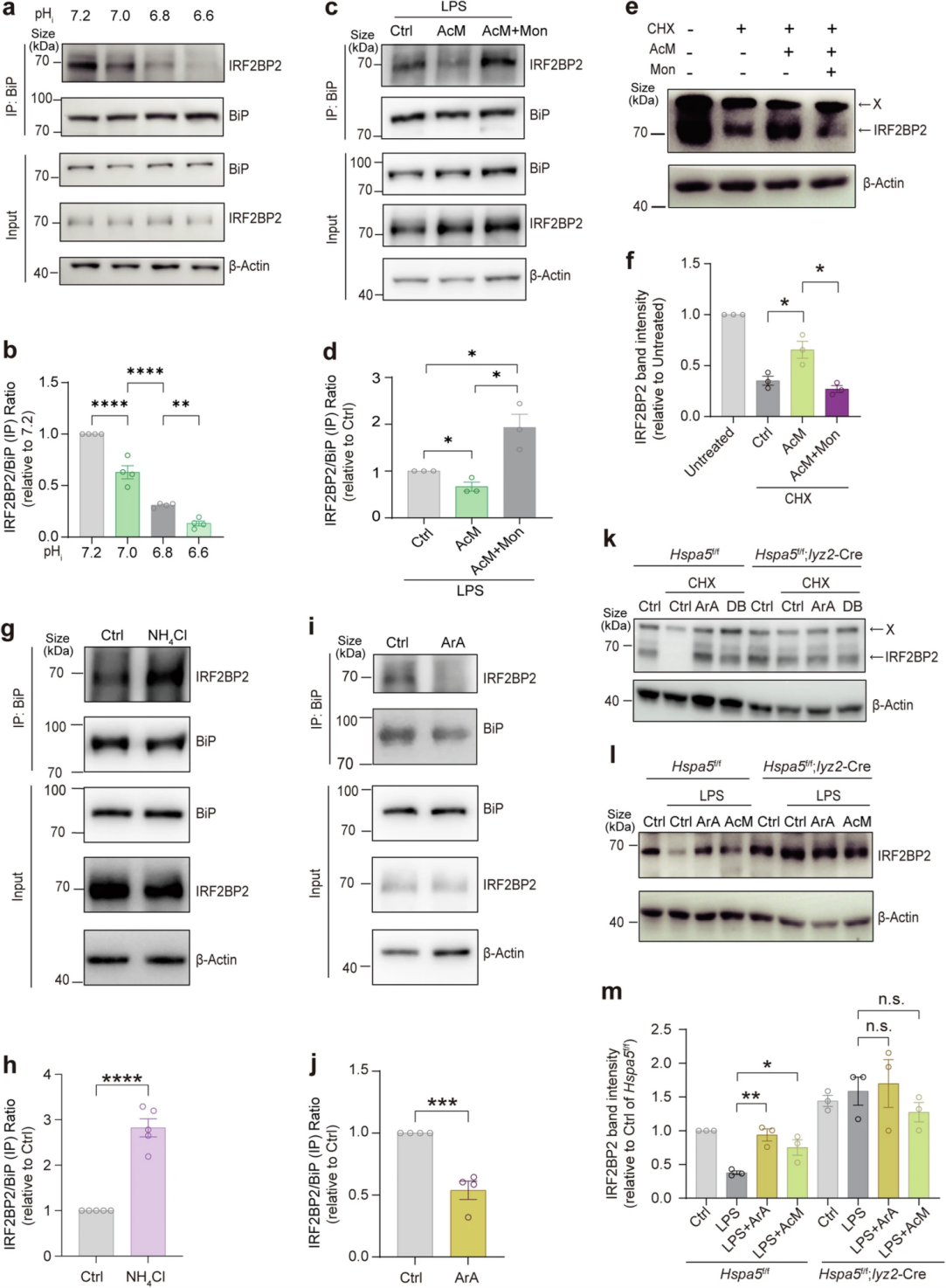
图6. BiP-IRF2BP2信号转导可独立于溶酶体pH值感应细胞内质子
据报道,某些羧酸盐代谢物因其二羧酸盐的高单质子化敏感性特性,主要通过pHi对酶功能和细胞通讯的影响起关键作用,L-苹果酸是一种内源性羧酸盐,其单质子化对弱酸性pH值敏感。在此背景下,作者研究了pH值对L-苹果酸-BiP-IRF2BP2轴的影响。SPR检测结果显示,酸性pH值有助于L-苹果酸抑制BiP-IRF2BP2的相互作用,并且酸化可增强SPR中L-苹果酸与BiP的结合。另一方面,L-苹果酸的羧酸盐类似物(如L-苹果酸盐、琥珀酸盐和顺式乌头酸盐)也可结合BiP,并以一种pH敏感的方式破坏BiP-IRF2BP2的相互作用。以上结果表明pH降低促进BiP结合羧酸盐而干扰BiP-IRF2BP2互作,BiP与羧酸盐代谢物结合具有pH敏感性,而L-苹果酸的高pKa、胞质水平、对BiP的亲和力,及可能缺乏促炎信号的能力则显示出其抗炎优势。
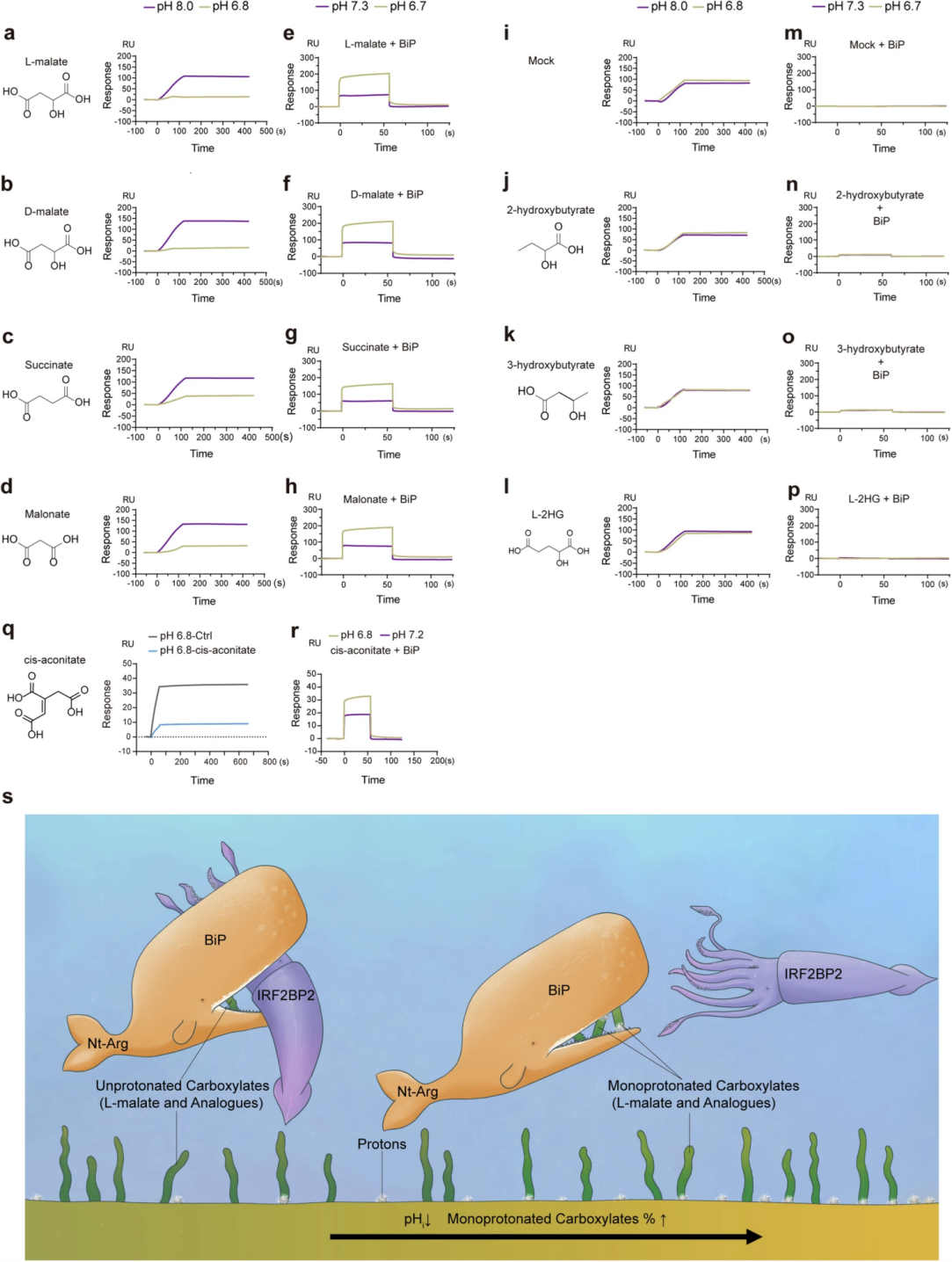
图7. 降低pH值有利于L-苹果酸及其类似物与BiP结合并抑制BiP-IRF2BP2的相互作用
最后,作者验证了BiP-IRF2BP2信号传导是否介导pH值波动对炎症反应的影响。在LPS诱导的BMDM中,酸化剂AcM可诱导IL-1β水平下调,质子载体碱化剂莫能菌素可诱导的IL-1β生成,pHi碱化剂NH4Cl显著上调IL-1β的水平,而BiP和IRF2BP2的缺乏则分别阻断了各pH调节剂的影响,这些实验共同证明BiP-IRF2BP2信号通路介导了pH波动对IL-1β产生的影响。在NaOH溶液诱导肠炎的小鼠模型中,作者发现直肠给药0.3%的NaOH引起小肠绒毛结构破坏、结肠缩短、以及炎性细胞因子IL-1β和IL-6的上调,而骨髓敲除BiP可消除结肠炎表型。IHC和WB结果显示NaOH处理下调了IRF2BP2蛋白丰度,而骨髓敲除BiP同样也检测到IRF2BP2的下调,作者推测这可能源于非髓系细胞对NaOH的反应。综上所示,以上结果证明了质子依赖性肠道免疫平衡的维持,其中BiP-IRF2BP2信号发挥了关键作用。
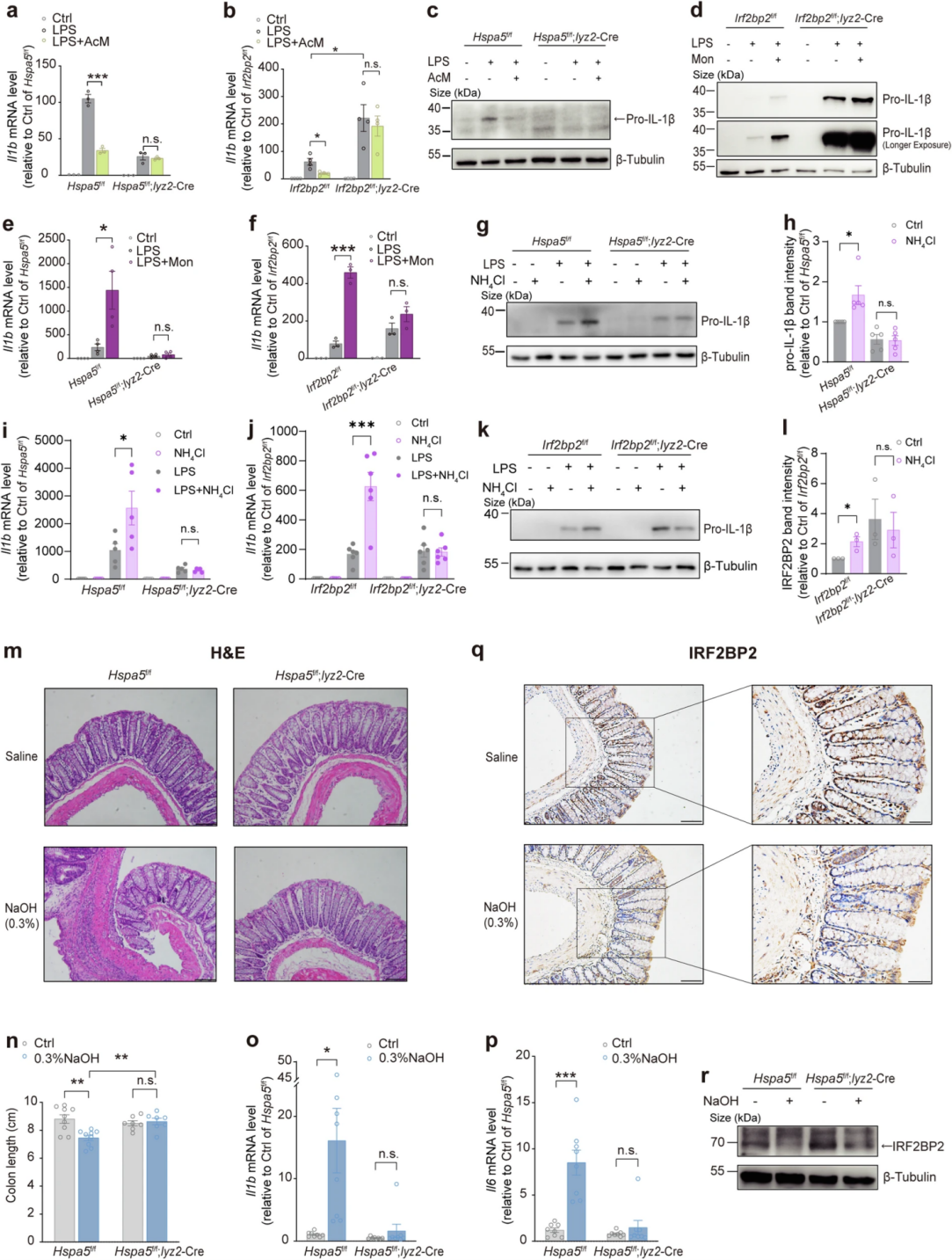
图8. pH值变化可通过BiP-IRF2BP2轴调节炎症
在本实验中,作者通过一系列实验,揭示了L-苹果酸作为细胞质pH值的感应分子,通过BiP-IRF2BP2信号通路调控炎症反应的新机制,某些具有不同pH敏感性的羧酸代谢物在蛋白质-蛋白质相互作用的质子生物传感中具有衔接作用。此发现为理解代谢与免疫系统的交互提供了新的视角,提出了通过调控细胞内的pH值或者靶向BiP-IRF2BP2信号通路来控制炎症介质表达的潜在治疗策略,对治疗炎症相关疾病具有重要意义。

查看更多

查看更多

查看更多

联系我们

返回顶部