查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
2025年1月,青岛大学的王建勋教授团队在《Acta Pharmaceutica Sinica B》期刊上发表了题为“Parkin inhibits iron overload-induced cardiomyocyte ferroptosis by ubiquitinating ACSL4 and modulating PUFA-phospholipids metabolism(Parkin通过泛素化ACSL4和调节PUFA -磷脂代谢抑制铁过载诱导的心肌细胞铁死亡)”的研究论文。研究中使用了汉恒生物提供的自噬双标腺病毒以研究Parkin对心肌细胞线粒体自噬的影响。

铁是一种不可或缺的微量元素,在能量代谢、核苷酸合成和DNA修复等多种生物过程中起着至关重要的作用,体内铁平衡紊乱可导致各种心血管疾病。铁过载可通过诱导氧化应激和脂质过氧化增加心血管疾病的风险,然而其具体作用机制尚不清楚。Parkin(PARK2)最初被确定为帕金森病相关基因,有研究发现糖尿病性心肌病、心肌老化、心脏肥厚等心脏疾病中,心肌细胞中Parkin的表达水平下调。因此,研究人员认为Parkin可能参与铁过载引发的心血管疾病。
铁过载与心脏病密切相关。铁死亡是心肌缺血再灌注(I/R)损伤中新发现的一种细胞死亡形式。然而,心脏铁过载引起心肌损伤的具体分子机制,以及铁死亡在铁过载引起的心肌损伤中的作用尚不清楚。本研究发现铁死亡参与铁过载和I/ R诱导的心肌病的发展。机制上,Parkin通过促进ACSL4(参与铁死亡相关脂质代谢途径的关键蛋白)的泛素化来抑制铁过载诱导的心肌细胞铁死亡,而转录因子p53可抑制铁过载心肌细胞中的Parkin表达,从而调节铁死亡。铁死亡抑制剂Fer-1可显著抑制铁过载诱导的铁死亡和心肌I/R损伤。此外,Parkin可有效保护线粒体功能,防止铁过载引起的线粒体脂质过氧化。研究结果表明p53 - Parkin- ACSL4信号通路通过抑制铁死亡减轻心脏疾病。
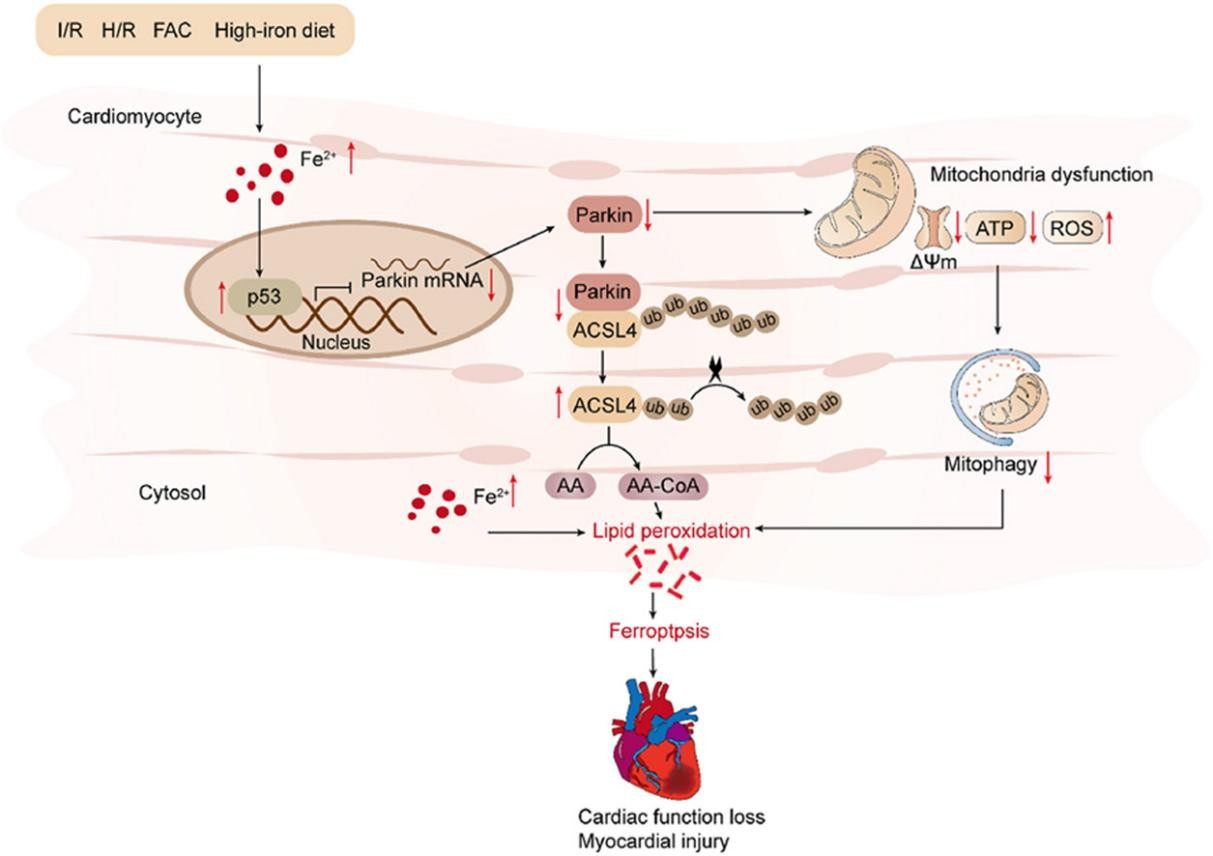
图1. p53 - Parkin - ACSL4信号轴调控铁死亡示意图
1. 铁过载诱导心肌细胞铁死亡,并促进体外缺氧复氧(H/R)引发的细胞死亡
首先作者使用铁铵柠檬酸盐(FAC)处理H9C2细胞和新生大鼠心肌细胞,发现随FAC浓度增加,细胞铁含量升高,死亡数量增加,脂质过氧化产物MDA的含量和铁死亡分子标记物Ptgs2的表达均显著上升(图2A-E)。接着,作者采用多种死亡抑制剂处理铁过载的心肌细胞(指新生大鼠和小鼠心肌细胞,下文统称为心肌细胞),结果显示只有铁死亡抑制剂(Fer-1)可逆转细胞死亡,而坏死凋亡抑制剂(Nec-1)和凋亡抑制剂(ZVAD)没有显著减轻细胞死亡或脂质过氧化(图2F-H)。这些数据表明,铁过载主要通过铁死亡途径诱导心肌细胞死亡。
H/R处理心肌细胞会导致其铁水平升高(图2I),使用低浓度FAC(25 μmol/L)进一步处理心肌细胞,细胞死亡增加,MDA浓度升高,而Fer-1处理可显著减轻这些影响(图2J和K)。以上结果表明,抑制铁死亡可减轻H/R诱导的细胞损伤。
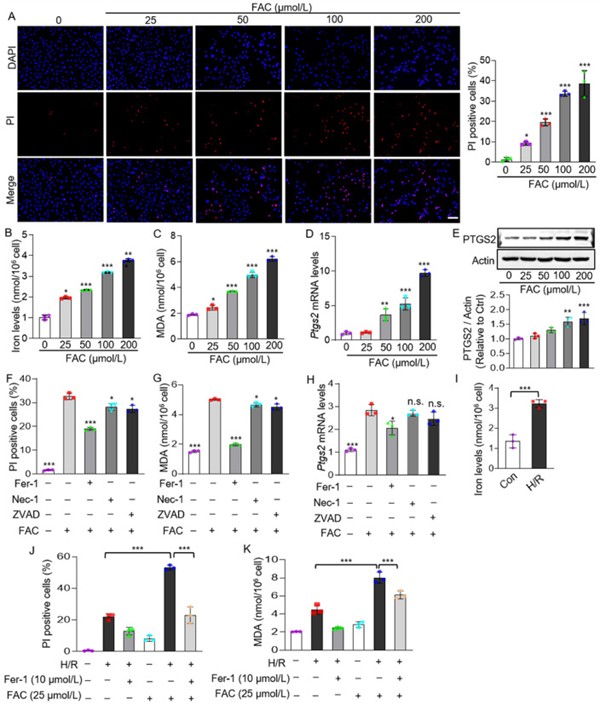
图2.铁过载诱导心肌细胞铁死亡,并促进H/R引发的细胞死亡
2. Parkin对铁过载所致铁死亡的体外抑制作用
先前有研究表明心脏疾病中心肌细胞中Parkin的表达水平下调,然而Parkin是否参与铁过载诱导的心肌细胞铁死亡尚不清楚。于是作者先测量了高浓度FAC(100 μmol/L)处理的心肌细胞和高铁饮食(HID)喂养小鼠心脏中的Parkin含量,体内外实验均显示相比对照组,铁过载组Parkin表达水平下降(图3A-C)。在高浓度FAC处理的心肌细胞中过表达Parkin可减少细胞死亡,同时降低MDA含量(图3E-G)。另外,作者发现FAC处理后心肌细胞中铁死亡相关蛋白表达量发生变化,TFR1、ACSL4表达升高,GPX4表达降低,而Parkin过表达可以抑制ACSL4的表达,但对TFR1和GPX4没有影响(图3H)。作者通过敲低Parkin进一步研究其对低浓度FAC处理的心肌细胞的影响,发现Parkin沉默会加重细胞铁死亡(图3J和K)。
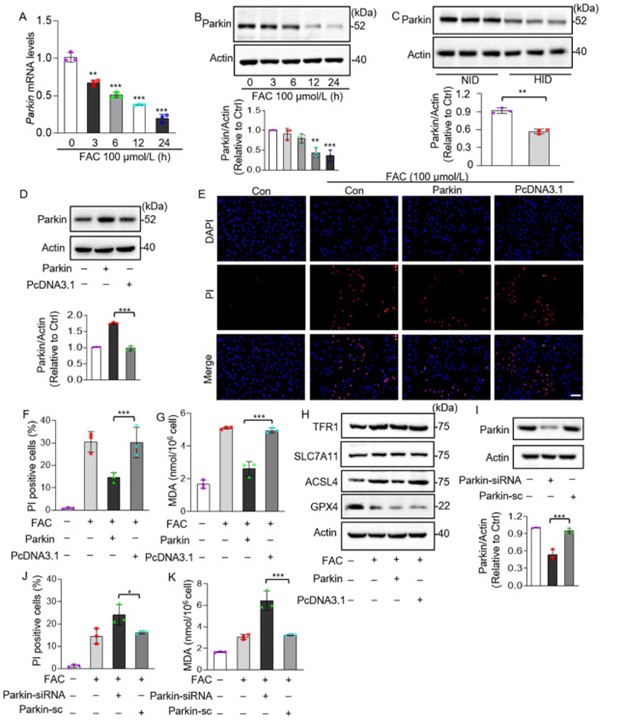
图3. Parkin抑制由铁过载引起的铁死亡
3. Parkin抑制铁过载引起的线粒体功能障碍
由于线粒体ROS过量产生会引起脂质过氧化进而导致铁死亡,于是作者进一步探究铁过载对心肌细胞线粒体功能的影响,以及Parkin在其中的作用。使用高浓度FAC处理心肌细胞,作者发现线粒体铁含量增加,线粒体膜电位、线粒体ATP和线粒体耗氧量显著降低,线粒体脂质ROS和线粒体ROS增加,而过表达Parkin或者使用Fer-1处理可逆转上述效应(图4A-F),表明Parkin可减轻铁过载引起的线粒体损伤。使用汉恒生物的自噬流检测腺病毒ADV-RFP-GFP-LC3感染心肌细胞,同时使用mitoSOX定位线粒体,检测线粒体自噬水平,发现FAC处理后显著降低了细胞线粒体自噬,过表达Parkin则能够恢复细胞自噬(图4G-H)。以上结果表明,Parkin在细胞铁过载的情况下能够刺激线粒体自噬,这可能有助于其对铁过载心肌细胞的保护作用。
图4. Parkin抑制铁过载引起的线粒体损伤
4. Parkin调节铁过载诱导的脂质过氧化
铁死亡由脂质过氧化引起,含有多不饱和脂肪酸(PUFA)的磷脂极易氧化,因此作者推测Parkin是通过调节脂质代谢来抑制铁死亡的。作者首先对FAC处理的心肌细胞进行了脂质组学分析,发现与正常心肌细胞相比,FAC处理的心肌细胞中磷脂酰乙醇胺(PE)浓度升高,而其他磷脂包括磷脂酰胆碱(PC)、磷脂酰丝氨酸(PS)和或磷脂酰肌醇(PI)浓度无明显变化,Parkin过表达可有效抑制铁过载导致的PE浓度升高(图5A-B)。接着,作者通过在细胞中添加PUFA(二十碳四烯酸,C20:4;二十二碳六烯酸,C22:5;和二十二碳六烯酸,C22:6)验证其诱导心肌细胞铁死亡的潜力,发现单独添加PUFA脂质过氧化产物MDA含量几乎无变化,而在FAC处理的心肌细胞中添加PUFA可导致MDA含量显著上升,在其基础上过表达Parkin后MDA含量下降。基于以上结果,作者认为Parkin可能是通过调节心肌细胞磷脂中PUFA来抑制铁过载引起的铁死亡。
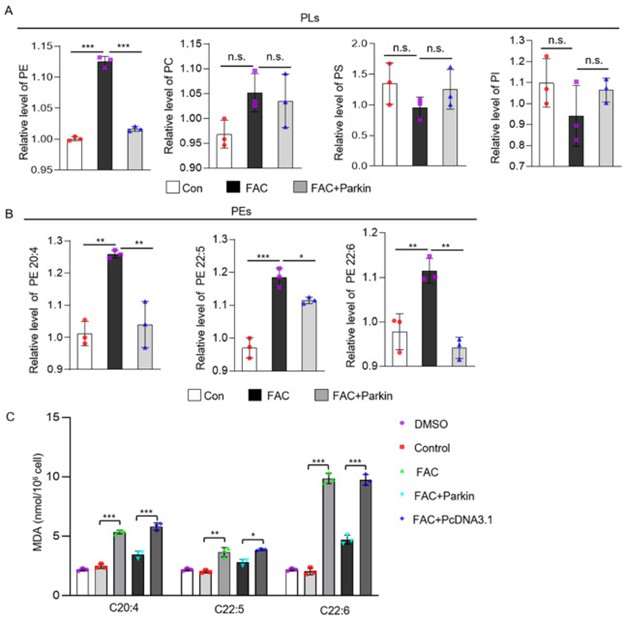
图5. Parkin调节脂质代谢
5. Parkin通过ACSL4调节细胞代谢抑制铁死亡
先前有研究显示ACSL4通过优先氧化PE调节脂质合成,于是作者推测Parkin可能通过靶向ACSL4调控PE中PUFA的含量。通过脂质组学分析,作者发现ACSL4的敲低抑制了铁过载引起的PE的增加(图6A),PE中PUFAs (C20:4、C22:5和C22:6)的水平也显著降低(图6B)。通过检测高浓度FAC处理的心肌细胞中的ACSL4含量,发现其蛋白水平随铁过载时间增加而上升(图6C),沉默ACSL4显著抑制铁诱导的细胞死亡(图6E)和脂质过氧化(图6F)。接着,作者通过在心肌细胞中过表达Parkin研究其与ACSL4的联系,结果显示Parkin过表达后ACSL4的表达下降(图6G)。在FAC处理的心肌细胞中过表达Parkin后细胞死亡减少,MDA含量下降,而过表达ACSL4则显著减弱了这些效应(图6H-J)。以上结果表明,Parkin通过靶向ACSL4调节铁诱导的脂质代谢。
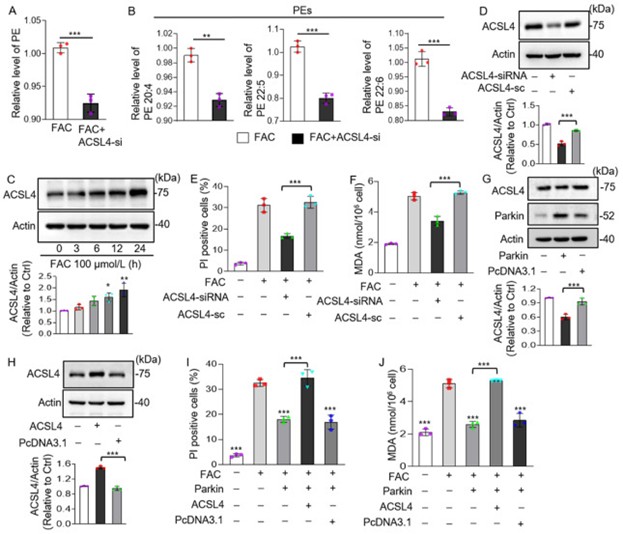
图6. Parkin通过ACSL4调节细胞代谢抑制铁死亡
6. Parkin与ACSL4结合并催化其泛素化
确定了Parkin的靶点,作者开始进一步探究Parkin作用于ACSL4的分子机制。通过免疫沉淀和表面等离子体共振实验作者确认Parkin和ACSL4直接相互作用(图7A-D)。有研究显示Parkin在泛素蛋白酶体依赖途径中作为E3泛素蛋白连接酶,作者分别在H9C2细胞和293T细胞中进行内源性和外源性泛素化实验,结果显示Parkin可增强ACSL4的泛素化和降解(图7E-F)。另外,作者发现Parkin通过野生型或K48泛素使ACSL4多聚泛素化(图7G)。这些结果表明,Parkin与ACSL4结合并通过K48连接的泛素链诱导ACSL4的多聚泛素化。
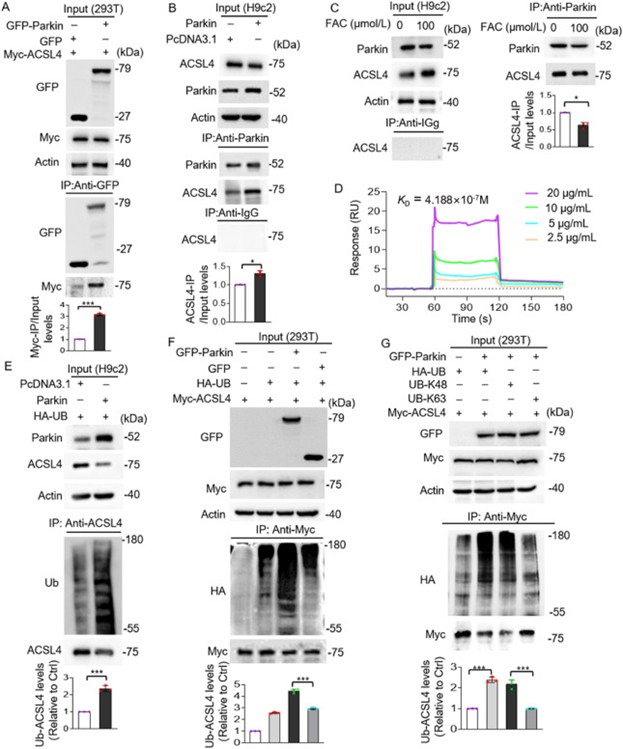
图7. Parkin与ACSL4结合并催化其泛素化
7. p53靶向Parkin调节铁过载诱导的铁死亡
p53是最常见的转录因子,有研究报道p53可以调控Parkin的表达。为了确定Parkin是否是p53的转录调控靶点,作者首先利用网站预测分析小鼠、人类和大鼠p53与Parkin启动子区域的结合位点,发现Parkin启动子区域包含一个最佳p53结合位点(图8A)。此外,ChIP实验也证实了p53与Parkin启动子区结合(图8B),表明p53在转录水平上调控Parkin。为了确定p53在铁过载诱导的铁死亡中的作用,作者使用FAC处理心肌细胞,观察到p53 mRNA水平和蛋白水平均明显上升(图8C-E)。p53过表达能够降低Parkin mRNA水平(图8F-H)。此外,p53敲低抑制FAC诱导的细胞死亡和脂质过氧化,但当Parkin同时被敲低时,这些作用被逆转(图8I-K)。这些结果表明p53通过调节Parkin的转录促进铁过载诱导的心肌细胞铁死亡。
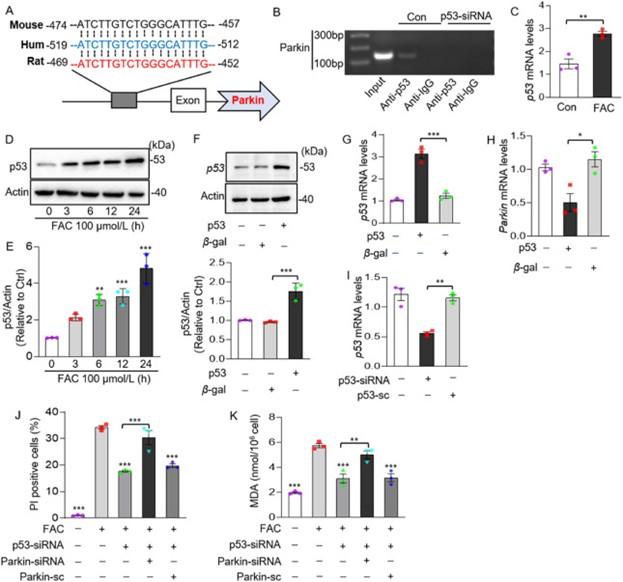
图8. p53靶向Parkin调节铁过载诱导的铁死亡
8. 铁过载的Myh6-CreERT2/Parkinfl/fl小鼠表现出组织铁死亡和心肌损伤水平升高
在体外实验确认Parkin抑制铁死亡的作用机制后,作者进一步利用体内实验进行验证。作者培育了Myh6-CreERT2/Parkinfl/fl小鼠,并在小鼠6周龄时,连续7天向Myh6-CreERT2/Parkinfl/fl小鼠腹腔注射他莫昔芬,特异性敲除小鼠心脏的Parkin基因后进行后续实验。高铁饮食喂养六周诱导铁过载,结果显示,与常规饮食的小鼠相比,高铁饮食的普通小鼠Parkin蛋白水平较低,ACSL4泛素化水平降低,另外Myh6-CreERT2/Parkinfl/fl小鼠(心脏特异性Parkin敲除小鼠)也检测出ACSL4泛素化水平降低(图9A-B)。高铁饮食组心肌细胞死亡增加,Ptgs2表达量和MDA含量均有所增加,Myh6-CreERT2/Parkinfl/fl小鼠心肌细胞铁死亡比高铁饮食组更为严重(图9C-G)。作者提取了Myh6-CreERT2/Parkinfl/fl小鼠的心肌细胞,在细胞中过表达Parkin,发现Parkin的重新表达可促进ACSL4泛素化,抑制铁死亡。以上结果再次证明了Parkin通过ACSL4影响铁死亡。
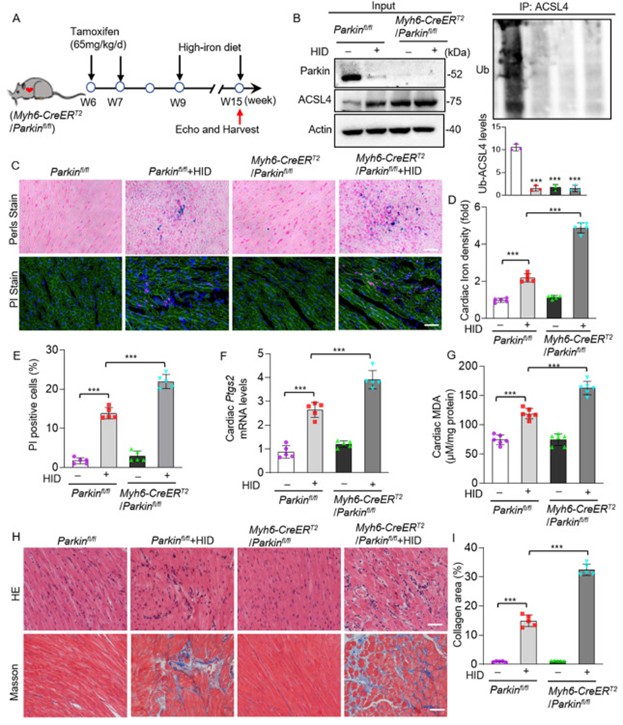
图9. 铁过载的Myh6-CreERT2/Parkinfl/fl小鼠表现出组织铁死亡和心肌损伤水平升高
9. Fer-1和Parkin可减轻I/R诱导的心肌损伤
作者以C57BL/6小鼠为实验对象进一步探讨铁死亡在心脏I/R损伤中的作用。小鼠高铁饮食六周并进行I/R手术,此外,部分小鼠在I/R手术前一天注射铁死亡抑制剂Fer-1(图10A)。结果显示高铁饮食小鼠与标准饮食小鼠相比,心肌梗死区域增加,注射Fer -1梗死区域减小(图10B-C)。此外,与假手术组相比,I/R处理组心肌铁含量、心肌细胞死亡百分比、Ptgs2 mRNA和MDA水平均有所增加,而在小鼠心脏I/R损伤期间向小鼠注射Fer-1可减少铁死亡,可减轻以上变化(图10D-G)。
此外,作者还构建了Parkin过表达小鼠来研究Parkin对I/R诱导的铁死亡和心肌损伤的影响,发现Parkin的过表达有效地抑制了I/R诱导的铁死亡和心肌损伤(图10I-O)。这些结果表明,使用铁死亡抑制剂Fer-1或过表达Parkin均改善I/R诱导的铁死亡和心肌损伤。
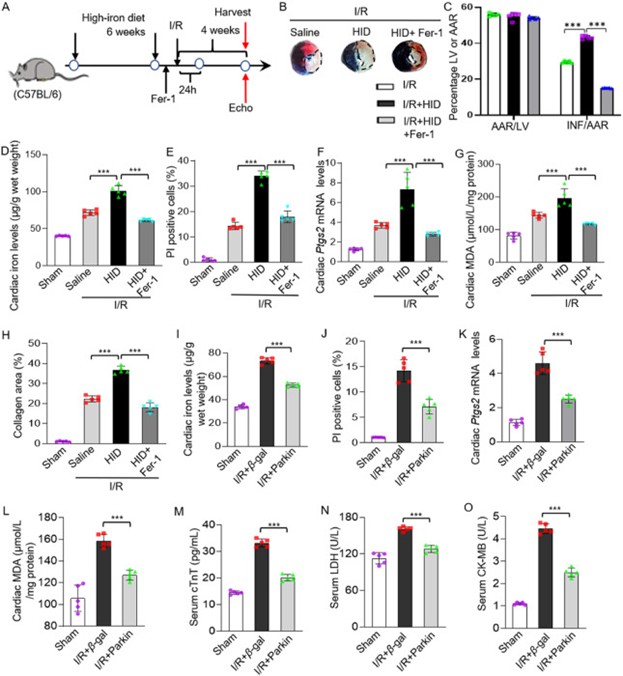
图10. Fer-1和Parkin可减轻I/R诱导的心肌损伤
综上所述,研究揭示了p53-Parkin-ACSL4的铁死亡通路,p53转录抑制Parkin的表达,从而抑制Parkin对ACSL4的泛素化,诱导心肌细胞发生铁死亡,最终损害心脏功能。该研究结果为预防心血管疾病提供了新的策略。

查看更多

查看更多

查看更多

联系我们

返回顶部