查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
急性肝衰竭(ALF)是一种罕见病症,表现为肝功能迅速出现异常,且病情不断发展、恶化,其特征为凝血功能障碍和肝性脑病,具有很高的死亡率。细菌侵袭、病毒感染、药物、毒素等因素作用下可能会引起ALF的发生。此外,ALF也是肝切除术后的致命并发症之一。除肝移植外,ALF仍缺乏有效的治疗策略。尿苷二磷酸葡萄糖(UDP-G)已被发现可促进肝脏修复,但关于UDP-G及其受体P2Y14R在ALF中的作用仍不明确。

2025年1月19日,中国药科大学胡庆华教授团队在Acta Pharmaceutica Sinica B(IF:14.7)杂志发表了题为《P2Y14R activation facilitates liver regeneration via CREB/DNMT3b/Dact-2/β-Catenin signals in acute liver failure》的研究论文。该研究报道了P2Y14R依赖CREB/DNMT3b/Dact-2/β-Catenin信号通路调节肝脏再生,缓解ALF的机制:即P2Y14R可通过肝细胞中CREB/DNMT3b信号通路调节Dact-2甲基化,抑制Dact-2的表达;而Dact-2可稳定β-Catenin降解复合体,其表达受抑制会使β-Catenin介导的肝脏再生被激活。且体内研究发现,对肝细胞癌(HCC)模型小鼠外源性补充UDP-G,可促进其部分肝切除术后肝功能的恢复,并延长其生存期。该研究论文揭示了P2Y14R在ALF中对肝脏再生的关键调控作用,为治疗ALF提供了一种潜在策略。
文章使用了汉恒AAV8-shDact2用于敲低大鼠肝脏Dact2基因
1. P2Y14R不足可通过抑制肝脏再生通路加剧ALF
为探究P2Y14R在ALF中的调节作用,作者结合GEO数据库分析发现P2Y14R在硫代乙酰胺(TAA)诱导或部分肝切除诱导的ALF中均表达升高(图1A)。接着作者在P2Y14R基因全身敲除(P2Y14R-/-)的大鼠上进行TAA诱导ALF(图1B),检测不同时间节点UDP-G的变化,发现UDP-G含量显著增加,并在48小时达到峰值(图1C)。且相对于野生组(WT组),P2Y14R-/-大鼠肝脏中丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)水平显著上升(图1D和E)。WT大鼠注射TAA 24h后,肝细胞坏死、肝索排列紊乱,同时伴有单核细胞和红细胞轻度浸润,48h后损伤程度达到峰值,72h后炎症浸润逐渐减少,且7天后完全修复。但P2Y14R的敲除加剧了TAA诱导的肝损伤(图1F)。随后,作者进一步研究P2Y14R敲除对肝脏代偿性再生的影响。在TAA诱导24h后,WT大鼠肝脏再生相关蛋白β-Catenin、p-GSK3β、c-Myc和CyclinD1的表达开始升高,并且在48h和72h内维持高水平。但其在P2Y14R-/-大鼠肝脏中的表达降低(图1G)。此外,免疫荧光也证实了β-Catenin的表达情况(图1H)。以上结果表明,P2Y14R基因敲除通过抑制β-Catenin介导的肝脏再生并延缓肝脏损伤修复来加剧TAA诱导的ALF。

图1. P2Y14R敲除通过抑制β-Catenin信号通路加重TAA诱导的ALF
2. P2Y14R不足通过抑制肝脏再生加重70%肝切除术后的ALF
为了研究P2Y14R是否对肝脏再生有直接影响,作者分别对WT、P2Y14R+/-和P2Y14R-/-大鼠进行了70%肝切除术(图2A)。检测发现与WT大鼠组相比,P2Y14R+/-和P2Y14R-/-大鼠组血清ALT和AST水平显著升高(图2B),肝脏再生率降低(图2C),且肝脏中Ki67阳性细胞也显著减少(图2D)。此外,P2Y14R-/-大鼠组在肝切除术后活性β-Catenin(非磷酸化,N-P-β-Catenin)、β-Catenin、p-GSK3β、CyclinD1和c-Myc的蛋白表达水平均降低(图E)。以上结果进一步说明P2Y14R的全身性敲除可通过抑制β-Catenin介导的肝脏再生通路加重ALF。
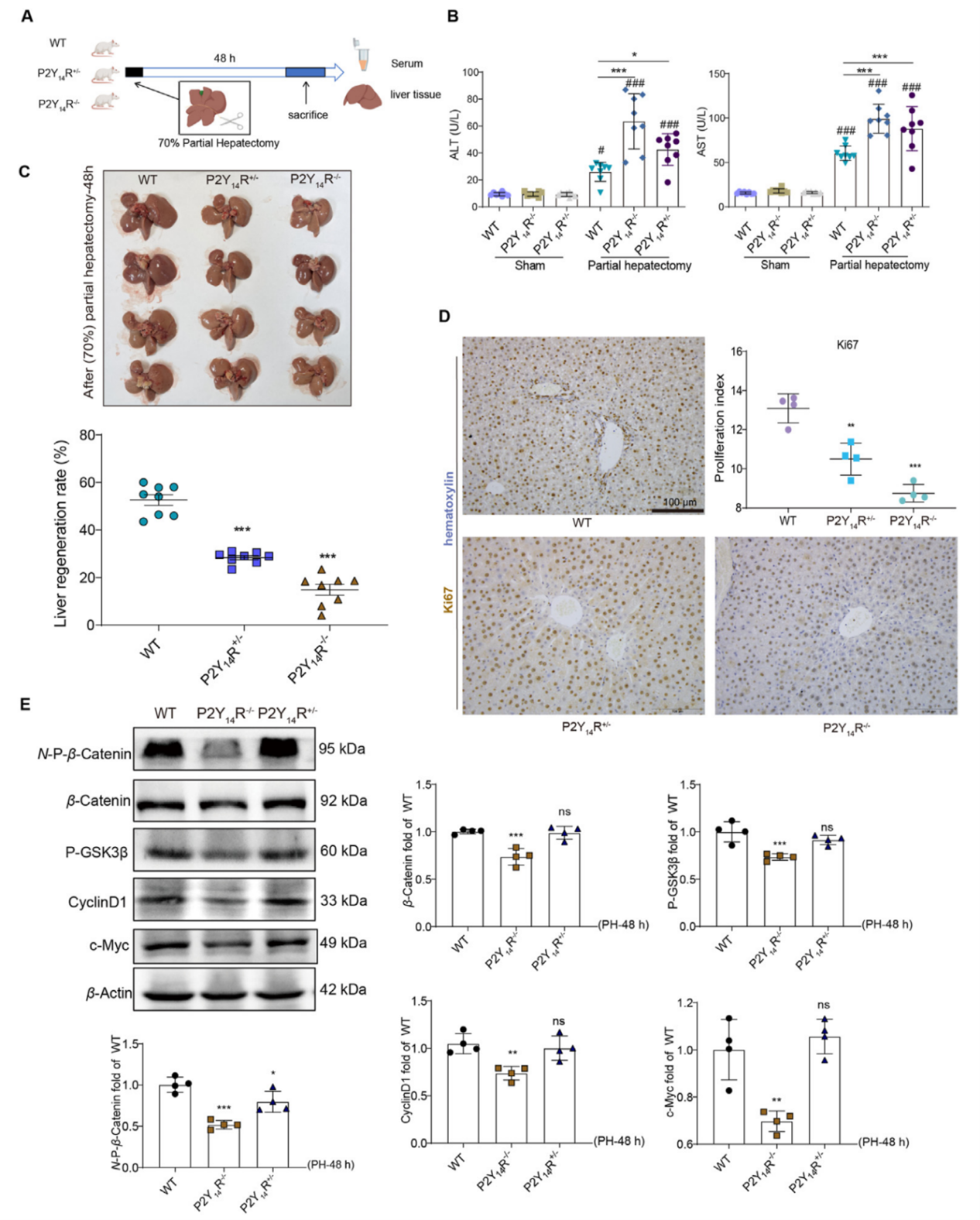
图2. P2Y14R不足抑制部分肝切除术后的肝脏再生
3. 在大鼠70%肝切除模型中,P2Y14R依赖Dact-2调节肝脏再生
为阐明P2Y14R调控肝脏再生的机制,作者对70%肝切除术后的WT和P2Y14R -/-大鼠进行了RNA测序。发现Dact-2在WT和P2Y14R -/-大鼠之间存在显著差异(图3A),且在P2Y14R -/-大鼠肝脏中,WB和免疫荧光结果均显示Dact-2的表达显著增加(图3B和C)。为探究P2Y14R对肝细胞再生调控是否依赖于Dact-2,作者对P2Y14R-/-大鼠注射AAV8-shDact2(汉恒生物提供)构建Dact-2基因敲低模型。4周后,Dact-2蛋白表达显著下调(图3D和E)。与对照组相比,Dact-2敲低组肝脏再生率提高(图3F),Ki67以及 N-P-β-Catenin、β-Catenin 、p-GSK3β和cyclinD1的表达也显著增加(图3G-J)。上述结果表明,Dact-2在P2Y14R介导的肝脏再生调控中发挥关键作用。
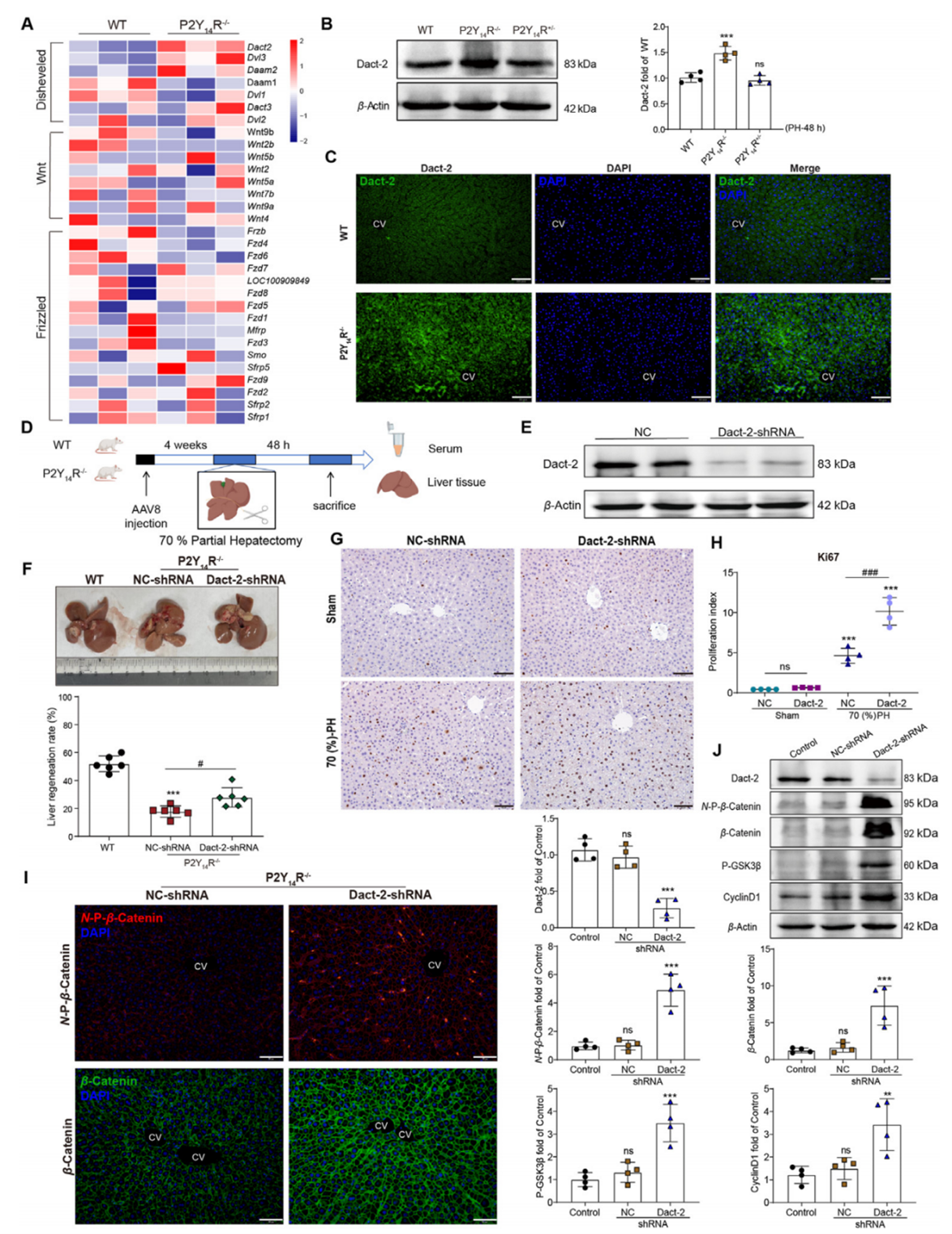
图3. 在70%肝切除模型中,P2Y14R依赖Dact-2调控肝脏再生信号
4. 肝细胞特异性敲除P2Y14R抑制肝脏再生
肝脏再生涉及多种细胞,包括肝星状细胞和肝细胞。因此作者利用肝星状细胞P2Y14R特异性敲除(P2Y14Rflox/floxLratcre/+)小鼠和肝细胞P2Y14R特异性敲除(P2Y14Rflox/floxAlbcre/+)小鼠研究部分肝切除术后肝脏再生情况(图4A)。观察发现,与WT小鼠相比,P2Y14R-/-小鼠的肝脏再生速率降低(图4B);P2Y14Rflox/floxLratcre/+小鼠与P2Y14Rflox/flox小鼠相比,肝脏再生速率没有显著差异(图4C)。由于P2Y14Rflox/floxAlbcre/+小鼠70%肝切除术后在24h死亡率达到100%,因此采用30%和50%肝切除术(图4D)。与P2Y14Rflox/flox小鼠相比,P2Y14Rflox/floxAlbcre/+小鼠的肝脏再生速率较低(图4E)。接着作者检测了部分肝切除术后相关蛋白的表达情况,与P2Y14Rflox/flox小鼠相比,P2Y14Rflox/floxAlbcre/+小鼠中p-GSK3β、c-Myc、CyclinD1和 N-P-β-Catenin的表达显著降低,Dact-2表达显著升高(图4F-I)。免疫荧光结果也显示P2Y14Rflox/floxAlbcre/+小鼠中N-P-β-Catenin和β-Catenin表达降低,Dact-2表达升高(图4J)。这些数据证实了肝细胞中P2Y14R通过Dact-2对β-Catenin的干预,来调控ALF后的肝脏再生。
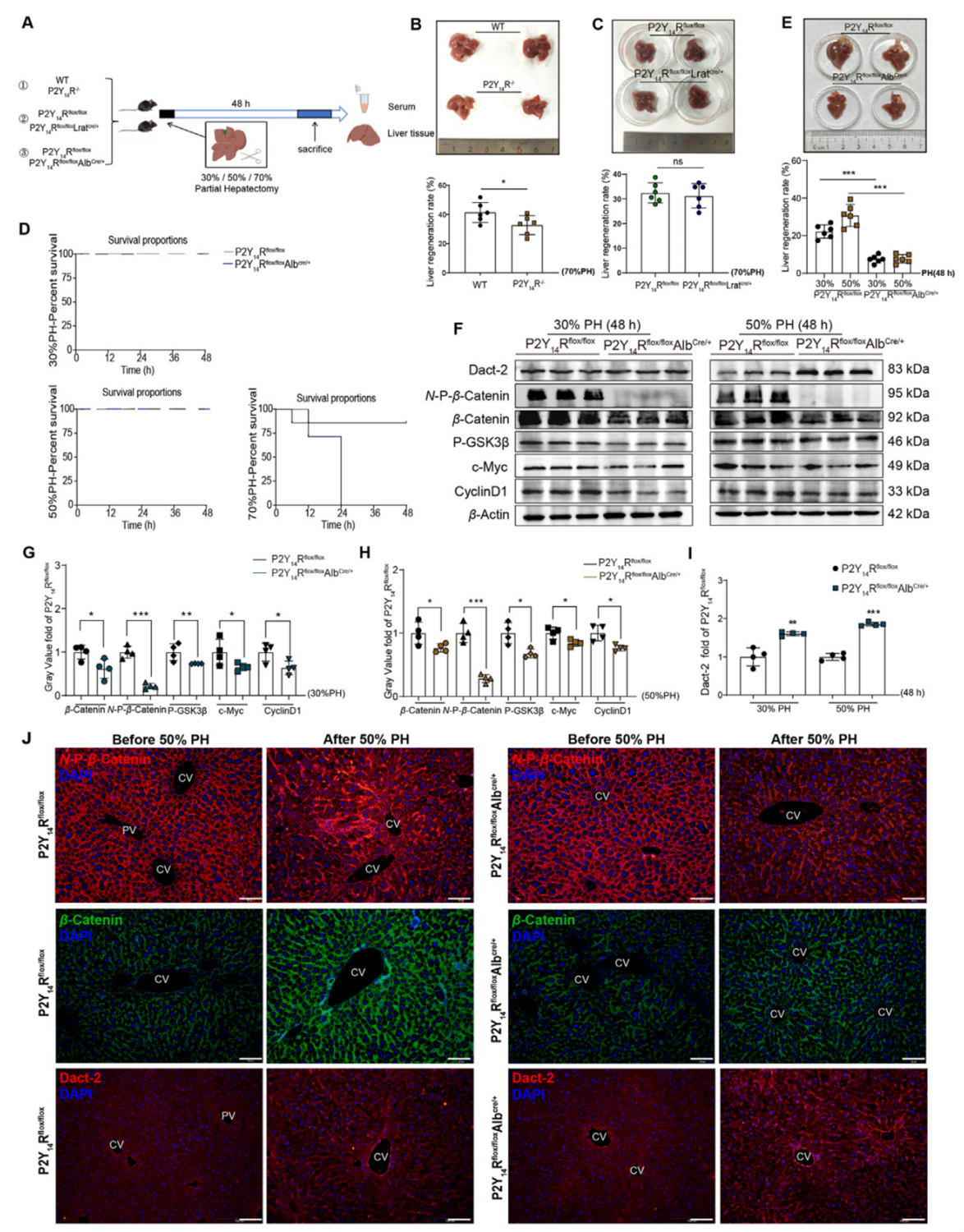
图4. 肝细胞特异性敲除P2Y14R可抑制部分肝切除术后的肝脏再生
5. UDP-G激活P2Y14R以依赖DNMT3b的方式调节Dact-2的甲基化水平
接着作者对P2Y14R调控Dact-2的机制进行了探究。检测发现在体外实验中,20 umol/L的UDP-G刺激可使LO-2和HepG2显著增殖(图5A),因此,选择此浓度用于后续给药。由于Dact-2启动子甲基化可使其表达下调,因此,作者研究P2Y14R是否调控Dact-2的甲基化。通过MethPrimer软件预测Dact-2启动子区域的CpG岛并设计引物,检测发现Dact-2启动子在人肝癌细胞系(SNU182,HepG2和SMMC-7721)中高度甲基化,而在LO-2中未发生甲基化(图5B)。但在P2Y14R过表达的LO-2中,Dact-2启动子甲基化水平显著升高(图5C)。DNMT可催化并维持甲基化,利用两种DNMT广谱抑制剂地西他滨(decitabine)和SGI-1027均可降低UDP-G刺激引起的LO-2细胞增殖(图5D)。在UDP-G刺激48h后检测DNMT各亚型mRNA表达显示,DNMT3b的表达显著增加(图5E)。DNMT3b的选择性抑制剂七尾霉素(Nanaomycin A)可显著抑制LO-2细胞的增殖,而DNMT3a和DNMT1的选择性抑制剂γ-谷维素(γ-oryzanol)无明显抑制作用(图5F)。为探究DNMT3b的上游分子机制,作者使用GTRO、UCSC和JASPAR网站预测到了7个与DNMT3b启动子结合的潜在转录因子(图5G)。由于作者前期研究中发现CREB是中性粒细胞中因P2Y14R缺失而激活的cAMP/PKA信号的下游通路。因此,作者利用JASPAR(阈值分数97.0)预测了CREB与DNMT3b的结合(图5H),并进行ChIP实验加以证实(图5I)。综上所述,在肝细胞中,UDP-G激活P2Y14R可介导CREB,CREB调控DNMT3b的表达,进而增加Dact-2的甲基化。

图5. UDP-G激活P2Y14R,以依赖DNMT3b的方式调节Dact-2的甲基化水平
6. 在HCC模型中,UDP-G处理有助于肝切除术后肝功能的恢复并延长总生存期
肝切除术是治愈HCC的最佳方法,因此作者进一步探究了激活P2Y14R在HCC肝切除术后早期阶段的作用。对HCC小鼠模型在第14天进行部分肝切除术,并通过皮内注射15 mg/kg的UDP-G,在第16天处死动物(图6A)。观察发现UDP-G处理组小鼠肝脏再生率高于对照组(图6B),且ALT、AKP(碱性磷酸酶)和DBIL(直接胆红素)水平均显著下调,AST水平无变化(图6C)。之后,作者对TCGA的RNA-seq数据进行了分析,并通过Kaplan-Meier Plotter分析了P2Y14R表达与临床之间的相关性。P2Y14R高表达的HCC患者,其总生存期、无进展生存期、无复发生存期和疾病特异性生存期均显著延长(图6D)。这些结果表明,UDP-G治疗可促进早期HCC术后恢复过程中的肝脏再生并改善肝损伤。接着,作者研究了UDP-G治疗是否会影响肝癌(HCC)小鼠的总体生存率和肿瘤大小(图6E)。分别皮内注射15 mg/kg和30 mg/kg的UDP-G对小鼠进行治疗,发现UDP-G显著延长了小鼠的总体生存期(图6F)。活体成像(VIS imaging)显示UDP-G治疗的小鼠与对照组小鼠的肿瘤大小并无显著差异(图6G)。综上结果表明,UDP-G治疗可延长小鼠的总体生存期,但不影响肿瘤大小。
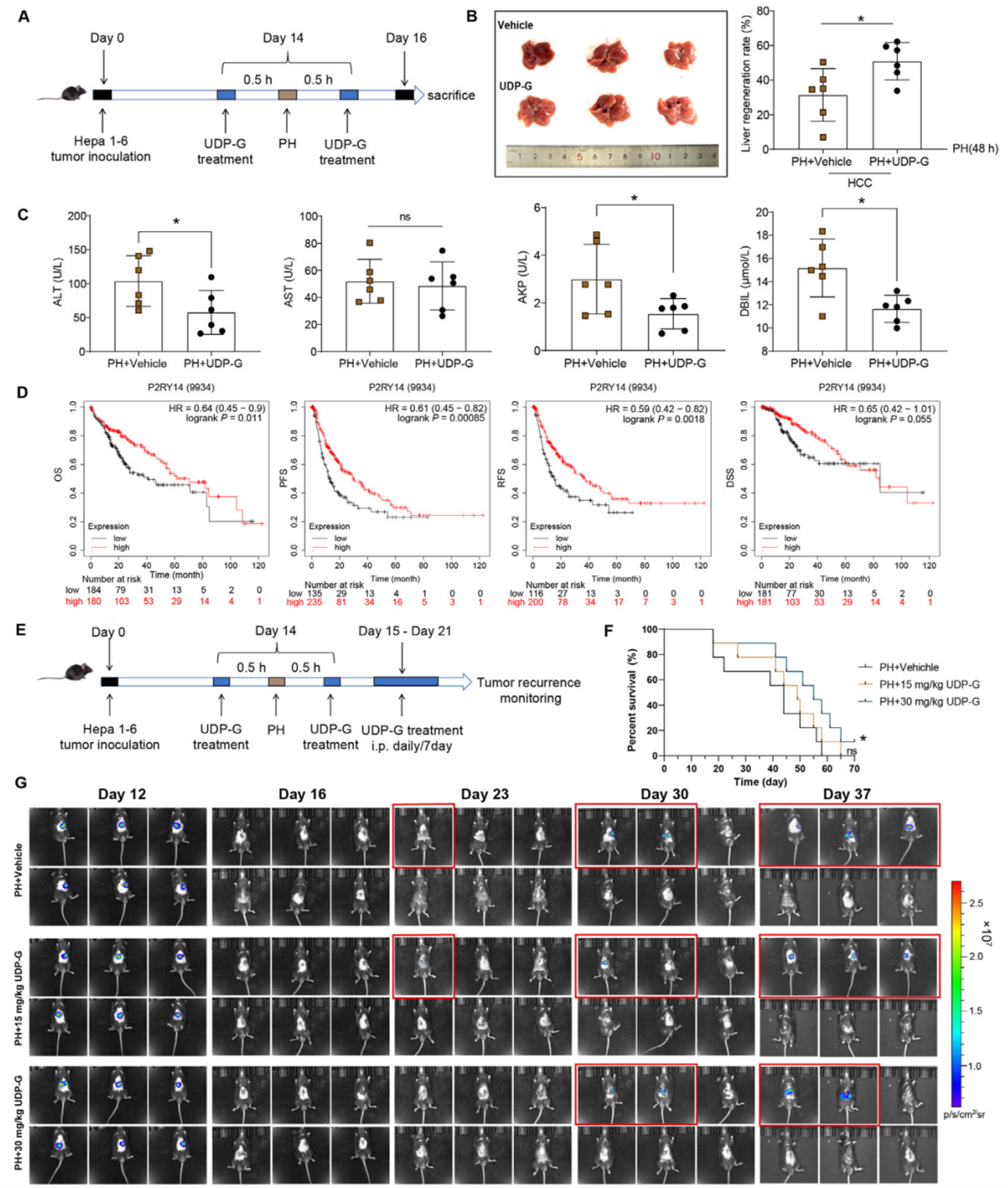
图6. 在HCC模型中,UDP-G治疗能够促进肝切除术后早期肝功能的恢复
综上,该研究揭示了ALF中UDP-G/P2Y14R轴调控肝脏再生的机制:在ALF中,UDP-G激活 P2Y14R后可通过CREB介导DNMT3b的表达,进而促进Dact-2的甲基化,增加β-Catenin的表达,从而促进肝脏再生并缓解ALF。此外,外源性UDP-G可以加速HCC小鼠部分肝切除术后的肝脏再生,延长总生存期。因此,开发长效P2Y14R激动剂或外源性补充UDP-G可作为治疗ALF的潜在药物。
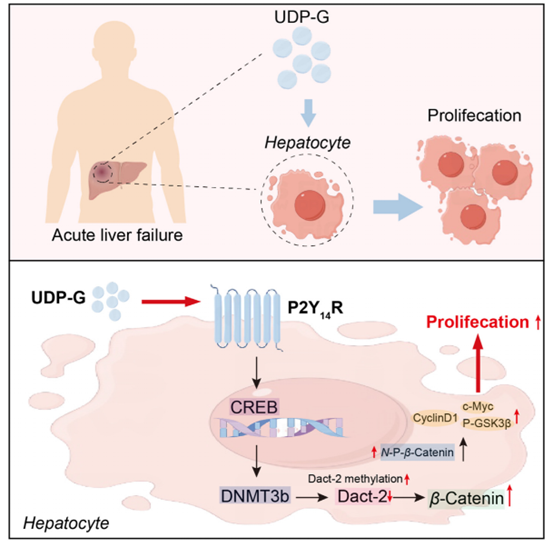
图7. UDP-G/P2Y14R轴调控肝脏病理过程示意图

查看更多

查看更多

查看更多

联系我们

返回顶部