查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
2025年2月27日,重庆医科大学第一附属医院旷梁/朱莹/白定群研究团队在《Advanced Science》(IF=14.3)上发表了题为“LIPUS Promotes Calcium Oscillation and Enhances Calcium Dependent Autophagy of Chondrocytes to Alleviate Osteoarthritis”的研究论文。该研究揭示了低强度脉冲超声(Low-intensity pulsed ultrasound,LIPUS)通过激活钙信号通路,调节软骨细胞自噬,从而延缓骨关节炎(Osteoarthritis,OA)进展的分子机制,为相关疾病的治疗提供了新的策略和方向。值得注意的是,在本研究中,作者使用汉恒生物提供的自噬双标腺病毒以研究LIPUS对软骨细胞自噬的影响。

OA是一种常见的退行性关节病,全球超过5亿人受到该疾病的影响,其显著降低病人的生活质量,加剧社会经济负担。OA的典型症状为疼痛、关节僵硬及功能障碍,目前的治疗策略以缓解疼痛症状和改善炎症为主。LIPUS是一种无创且安全的物理治疗手段,通过机械效应缓解OA进展,但是其潜在作用机制尚不清楚。
在这篇文章中,作者利用活细胞实时成像技术,在小鼠和斑马鱼中观察到LIPUS可以显著激活软骨细胞内的钙离子(Ca2+)信号(表现为明显的钙振荡),并进一步证实其可以激活软骨细胞的自噬,且这一过程依赖于钙信号通路。接着,作者通过遗传学手段敲低或阻断瞬时受体电位离子通道4(TRPV4,一种在软骨细胞中高表达的机械敏感性离子通道)蛋白的表达,发现其抑制了LIPUS诱导的钙振荡和自噬激活,提示TRPV4在介导上述生物效应中起着关键作用。最后,结合药物治疗,作者发现适度的腺苷酸二磷酸肌醇(IP3)受体激动剂能够加强LIPUS促进的钙振荡和自噬作用,进一步增强软骨保护效果,为优化LIPUS治疗OA提供了新思路。
下面,我们一起来了解具体的研究内容:
研究成果
1. LIPUS激活软骨细胞Ca2+信号
软骨细胞是一种具有机械敏感特性的细胞,其内Ca2+是响应物理刺激的最早且最基础的信号之一。作者使用白细胞介素-1β(IL-1β)刺激小鼠原代软骨细胞建立炎症性软骨细胞模型。活细胞实时成像结果显示:在未接受LIPUS处理的对照组(Ctrl组)中,钙探针荧光信号显示炎症性软骨细胞仅表现出零星且低幅度的钙振荡;而在LIPUS处理组(LIPUS组)中,钙振荡显著增强。在Ctrl组中,炎症性软骨细胞表现出异步的自发钙振荡,响应曲线相对平缓。而在LIPUS组中,荧光强度轨迹在刺激期间(两条红线之间)显示出多个明显的峰值。LIPUS处理后,部分钙峰逐渐恢复至基线水平,而少数细胞表现出延迟的钙峰。统计分析显示,LIPUS使钙振荡频率和幅度分别增加了近3倍和2倍。此外,LIPUS显著提高了钙响应性软骨细胞的比例。这些结果表明,LIPUS在体外能够诱导炎症性软骨细胞产生钙振荡。
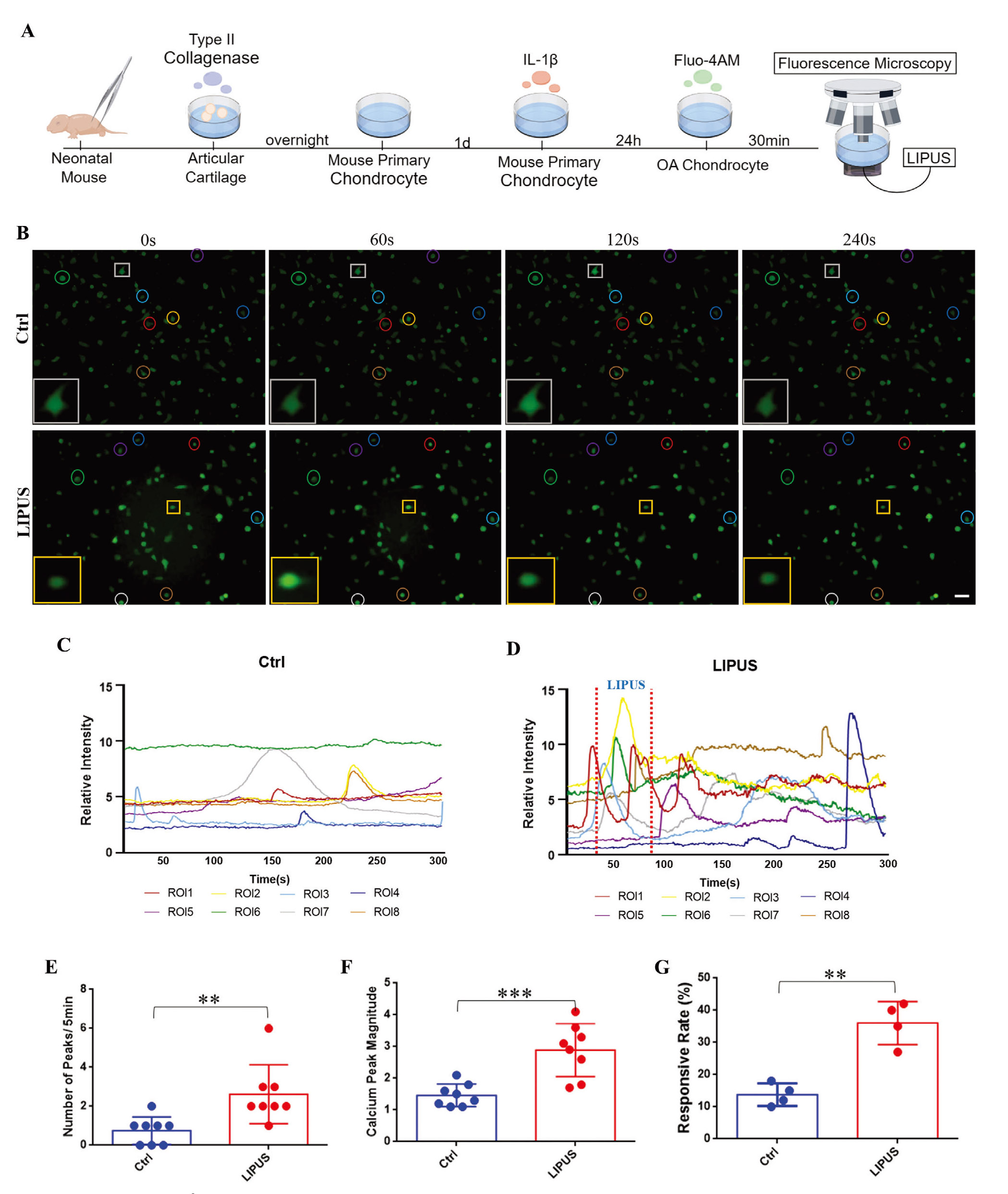
图1. LIPUS激活炎症软骨细胞的Ca2+信号
为了进一步研究LIPUS在体内的生物效应,作者利用斑马鱼幼体模型验证了LIPUS对软骨细胞钙信号的激活作用。GCaMP6s转基因斑马鱼品系以其高灵敏度和稳定性著称,能够动态监测细胞内钙离子浓度。作者用LIPUS处理GCaMP6s斑马鱼幼体,并在共聚焦显微镜下进行实时钙成像观察。结果显示:LIPUS处理前,ROIs(5个清晰可见的软骨细胞被不同颜色的圆圈标记为感兴趣区域)中仅出现零星且低幅度的钙峰;LIPUS刺激期间,钙峰逐渐显现且幅度增加。有趣的是,ROIs中的钙振荡并未随LIPUS处理停止而消失,反而在停止后钙峰幅度进一步增加。由此表明LIPUS在活体组织中激活了软骨细胞的Ca2+信号,并产生了持续效应。总之,以上研究表明作者首次将LIPUS介导的不可见机械效应转化为活体软骨细胞中可见且可量化的钙振荡信号,揭示了软骨细胞响应LIPUS处理的机制,为理解LIPUS介导的机械信号转导奠定了重要基础。
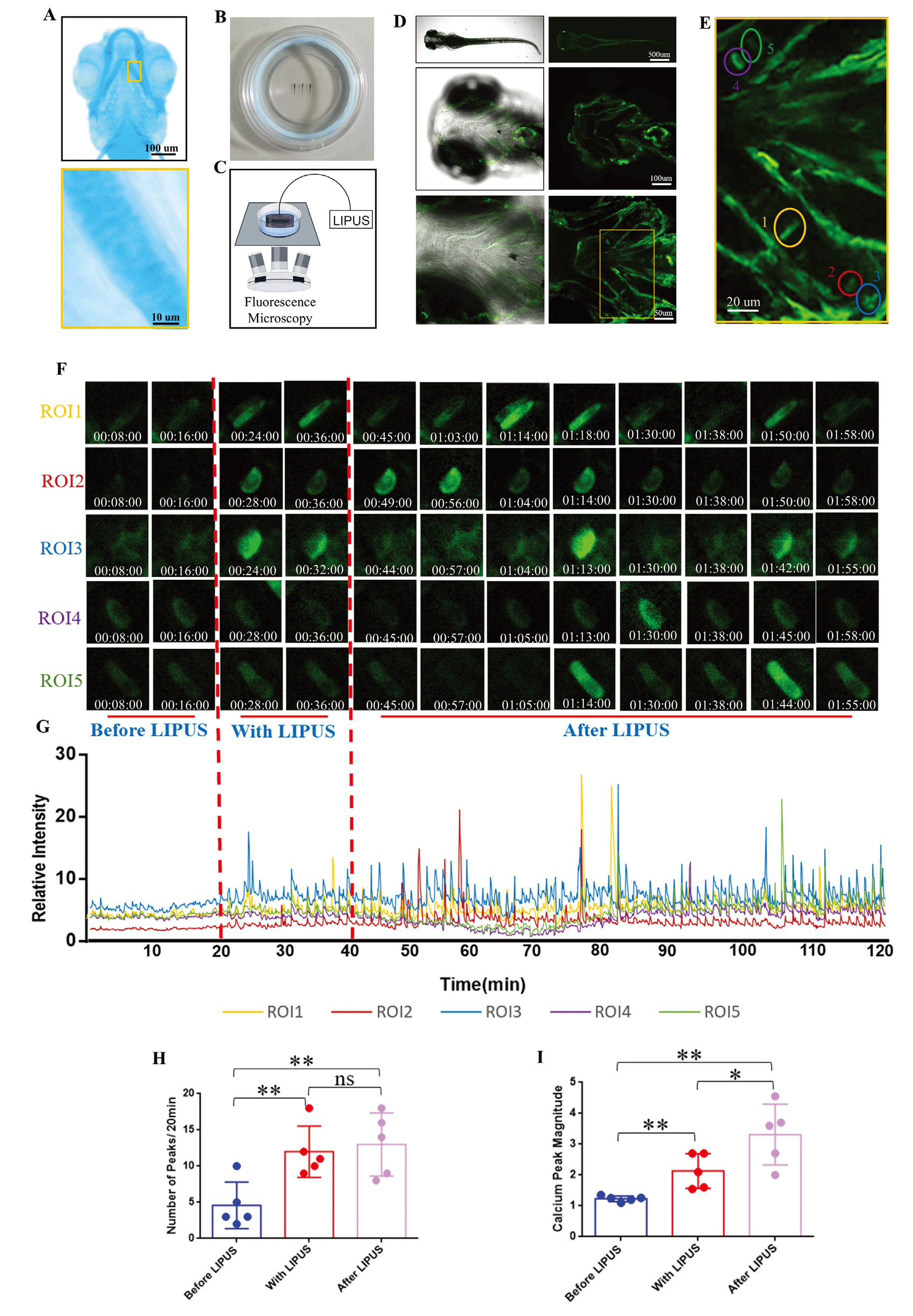
图2. LIPUS促进活体斑马鱼软骨细胞钙振荡
2.LIPUS通过钙依赖方式上调软骨细胞自噬
自噬是维持软骨稳态的关键机制,先前研究表明,LIPUS可通过上调巨噬细胞和间充质干细胞的自噬缓解骨关节炎。因此,作者探究了LIPUS对软骨细胞自噬的影响。作者通过内侧半月板失稳(DMM)手术建立小鼠骨关节炎模型,术后,小鼠接收2周的LIPUS治疗(实验分为4组:假手术(Sham)组;DMM组;DMM+LIPUS(30 mW/cm2)组和LIPUS(50 mW/cm2)。免疫组化结果显示:DMM组软骨中自噬标志物LC3和ATG7的表达较Sham组降低,而LIPUS(30 mW/cm2和50 mW/cm2)显著提高了LC3和ATG7的蛋白水平,但两种强度间无显著差异。这表明LIPUS能够恢复DMM诱导的骨关节炎小鼠软骨细胞的自噬水平,凸显其在骨关节炎治疗中的潜在作用。
为了明确LIPUS是否直接调控软骨细胞自噬,作者进行了体外实验。由于自噬的动态过程,作者收集了LIPUS处理后不同时间点的蛋白做WB检测,结果显示:LIPUS处理2 h后,自噬标志物LC3-II的表达显著升高。此外,作者还检测了不同LIPUS强度(30 mW/cm2 ,40 mW/cm2 和50 mW/cm2)对软骨细胞自噬的影响,结果显示所有强度均能上调自噬水平,但组间无显著差异。此外,通过透射电镜观察到LIPUS处理的软骨细胞中自噬体数量增加。这些结果表明,LIPUS直接增强了软骨细胞的自噬。
为了进一步探讨LIPUS增强软骨细胞自噬是通过增加自噬通量还是抑制自噬降解,作者利用红色荧光自噬探针DAPRed进行活细胞成像,监测软骨细胞的自噬通量。结果显示,IL-1β组的红色荧光呈弥散分布且无明显变化,而LIPUS刺激后荧光逐渐增强、扩大并聚集成簇。此外,作者利用RFP-GFP-LC3腺病毒感染软骨细胞,荧光成像结果显示:LIPUS处理后,IL-1β刺激的软骨细胞中RFP标记的自噬溶酶体和GFP标记的自噬体数量均增加。之后,作者用巴弗洛霉素A1(BafA1)阻断自噬溶酶体降解后,LIPUS进一步促进了BafA1预处理软骨细胞中LC3-II的积累。这些结果充分证明,LIPUS在体外直接增强了软骨细胞的自噬通量。
接着,为了阐明LIPUS诱导的钙振荡与上调软骨细胞自噬之间的关系,作者检测了钙信号相关分子钙调蛋白依赖性蛋白激酶(CaMK II)及其下游效应分子AMP活化蛋白激酶(AMPK)(两者均参与自噬调控)的表达。WB结果显示,LIPUS显著提高了CaMK II和AMPK的磷酸化水平,且在停止处理后30min效果最显著。相反,用细胞内钙螯合剂BAPTA-AM预处理软骨细胞后,LIPUS的自噬增强效应被显著抑制。这表明LIPUS可能通过Ca²⁺-CaMK II-AMPK信号通路调控软骨细胞自噬。综上,LIPUS通过钙依赖方式上调软骨细胞自噬。
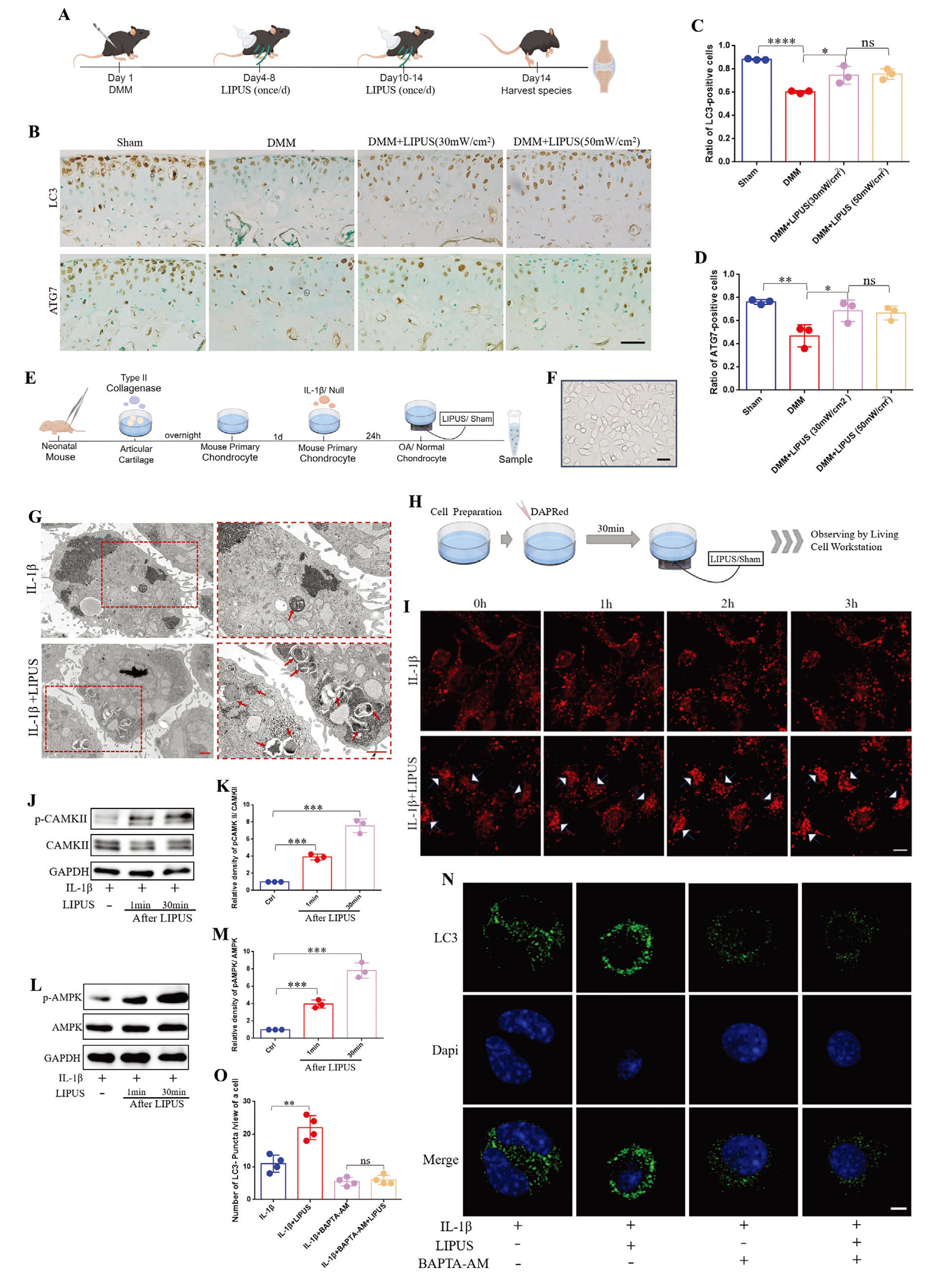
图3. LIPUS通过钙依赖方式上调软骨细胞自噬
3. LIPUS通过自噬维持软骨稳态
已有研究表明,软骨细胞自噬在OA进展中起着关键作用,因此,作者推测LIPUS缓解OA进展的作用可能与其调控软骨细胞自噬有关。作者通过体内外实验,在自噬缺陷状态下验证了LIPUS对OA进展的影响。ATG7是软骨细胞自噬的关键基因,与软骨发育和OA进展密切相关。作者通过他莫昔芬(TM)诱导Cre重组酶表达,构建了软骨细胞特异性ATG7条件性敲除小鼠(ATG7flox/flox Col2a1-CreERT2,简称ATG7cKO),并在ATG7cKO小鼠和对照小鼠中评估了LIPUS对OA进展的治疗作用。番红O-固绿染色显示,与DMM组相比,LIPUS治疗的对照组小鼠蛋白多糖流失和关节软骨退变显著减轻;而在ATG7cKO小鼠中,这种治疗效果明显减弱。并且,OA评分结果显示,胫骨的最大评分和总分均表明,LIPUS的治疗效果在ATG7cKO小鼠中被显著削弱。此外,作者检测了软骨基质的关键成分II型胶原(Collagen II)和基质金属蛋白酶-13(MMP-13)的表达水平。免疫组化结果显示,DMM手术后,对照组和ATG7cKO小鼠的Collagen II蛋白水平均显著降低,而MMP-13阳性细胞率显著升高。LIPUS治疗后,对照组小鼠的Collagen II和MMP-13表达模式发生逆转,但在ATG7cKO小鼠中未观察到显著变化。这些结果表明,LIPUS的治疗效果依赖于软骨细胞自噬。
为了进一步研究LIPUS增强自噬对维持细胞外基质合成与降解平衡的作用,作者利用BafA1阻断体外软骨细胞的自噬。WB结果显示,在BafA1预处理的细胞中,IL-1β组和IL-1β+LIPUS组的Collagen II或MMP-13水平无显著差异。免疫荧光和甲苯胺蓝染色结果一致表明,LIPUS促进细胞外基质合成的作用部分依赖于软骨细胞自噬。总之,LIPUS通过自噬途径维持软骨稳态。
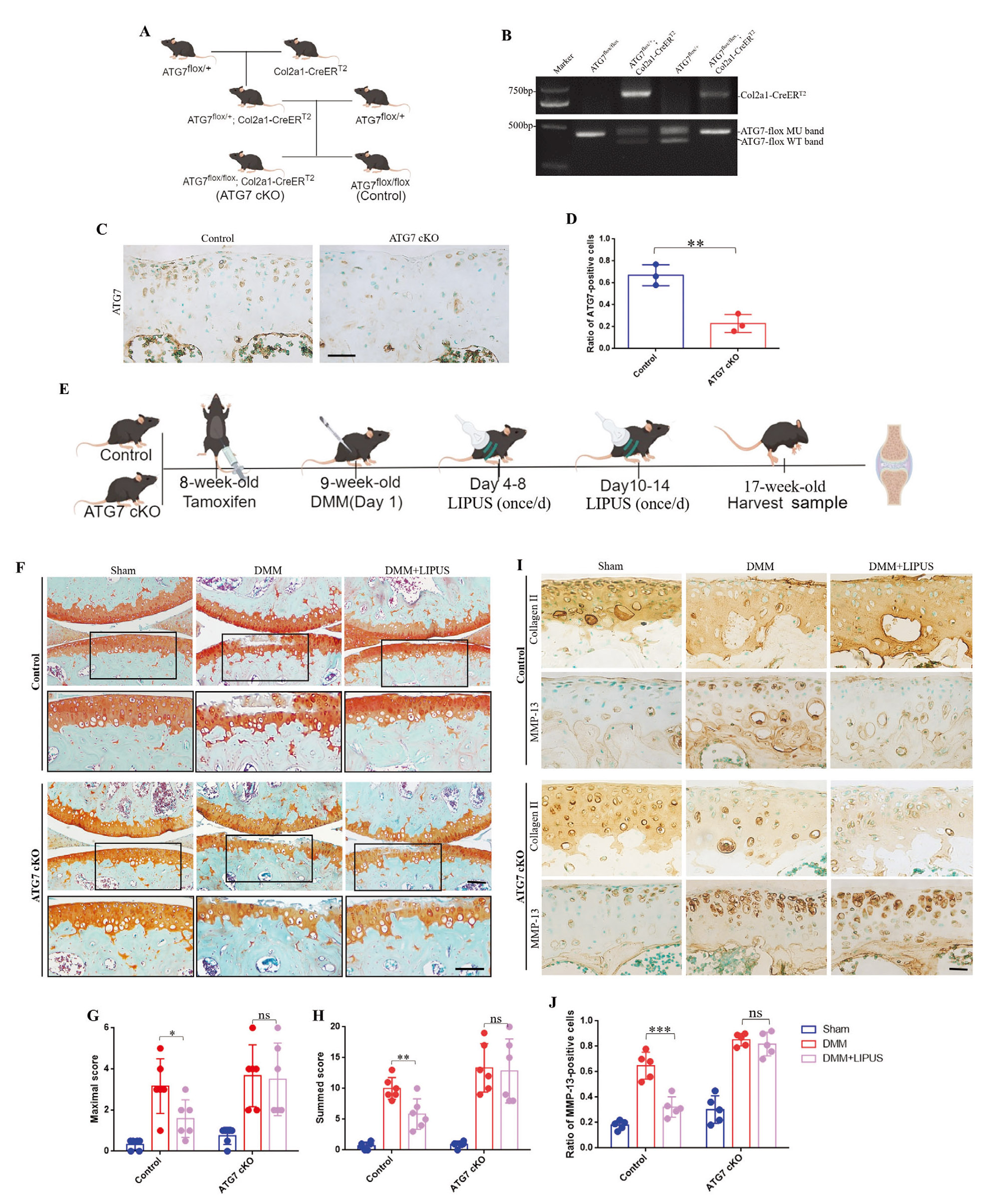
图4. LIPUS通过自噬维持软骨稳态
4. 机械敏感性离子通道TRPV4介导LIPUS诱导的钙信号激活及自噬促进作用
作为具有固有机械敏感特性的细胞,软骨细胞因其表面表达多种机械激活(MA)离子通道(如Piezo1、Piezo2和TRP家族通道)而能够将物理刺激转化为细胞内信号级联反应。为了进一步探索LIPUS与软骨细胞之间的机械信号转导机制,作者从NCBI基因表达数据库获取已发表的单细胞RNA测序数据(GSE211584)进行重分析,发现大多数基因在特定细胞中集中高表达,而TRPV4基因在软骨细胞中的特异性高表达。之后,作者通过UMAP分析(Uniform Manifold Approximation and Projection,无监督降维和数据可视化技术)和免疫组化检测,进一步验证了TRPV4在小鼠软骨细胞中的丰富表达和特异性分布。
已有研究表明TRPV4参与软骨细胞分化和OA进展,由此,作者推测TRPV4可能是连接细胞外物理化学刺激与软骨细胞内生化信号的关键整合因子。因此,作者利用siRNA下调软骨细胞中TRPV4的表达以及TRPV4特异性阻断剂GSK205阻断软骨细胞中TRPV4的表达(LIPUS;si-TRPV4+LIPUS;GSK205+LIPUS),钙成像分析结果显示:当TRPV4被敲低或阻断时,LIPUS诱导的钙峰数量、幅度和细胞响应率均受到抑制。这些结果证明TRPV4介导了LIPUS对软骨细胞钙信号的调控。
为研究TRPV4是否介导LIPUS对软骨细胞自噬的上调作用,作者在LIPUS处理前用GSK205预处理软骨细胞(IL-1β组;IL-1β+LIPUS组;IL-1β+LIPUS+GSK205组)。结果显示,阻断TRPV4后,LIPUS上调的LC3 II蛋白水平、LC3斑点数量和自噬体数量均受到抑制。此外,作者推测TRPV4也参与LIPUS维持软骨稳态的过程。Western blot显示,在GSK205预处理的细胞中,IL-1β组和IL-1β+LIPUS组的Collagen II或MMP-13水平无显著差异,免疫荧光结果与此一致。以上结果表明,LIPUS维持软骨稳态的作用也部分依赖于TRPV4。
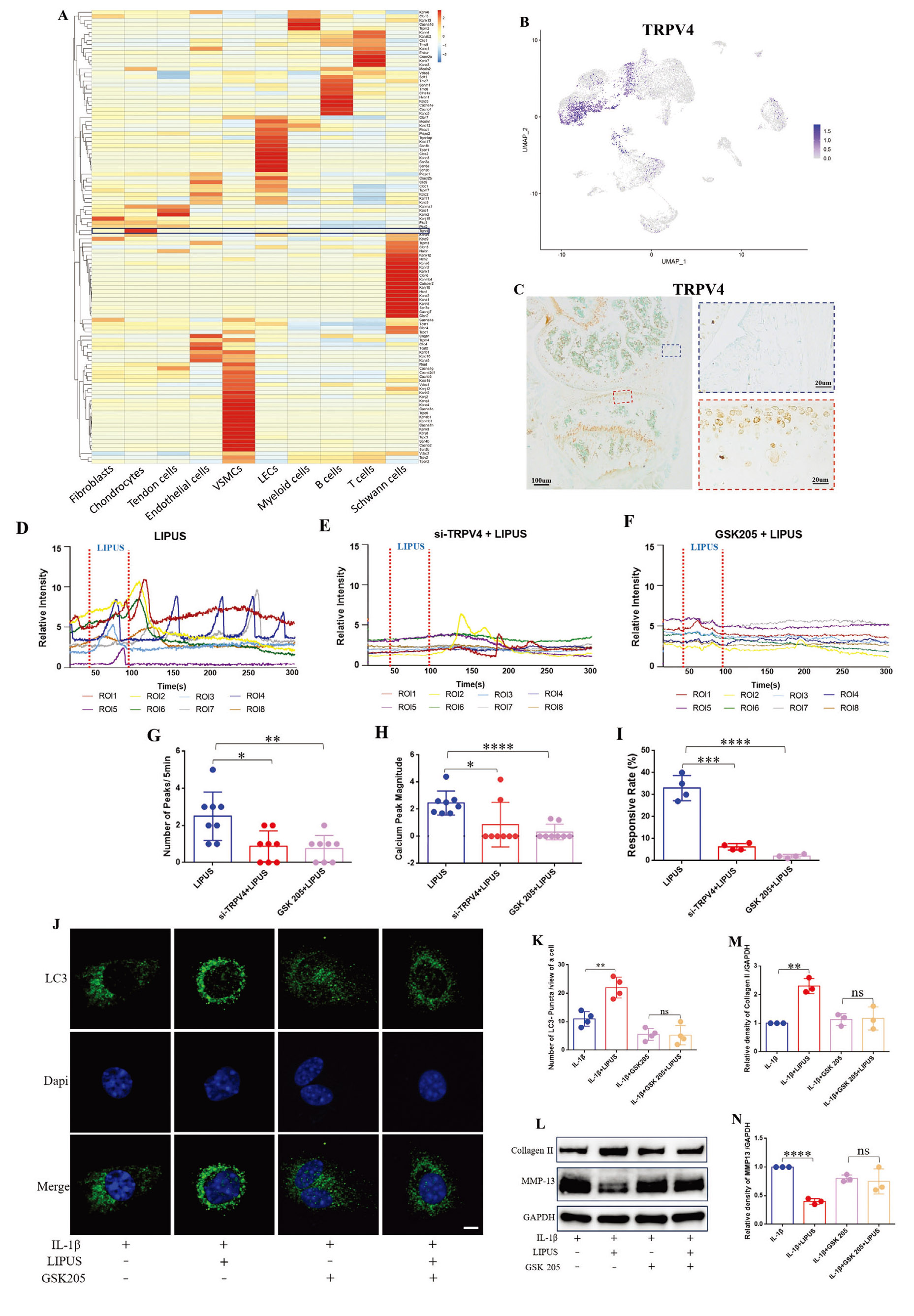
图5. 机械敏感性离子通道TRPV4介导LIPUS诱导的钙信号激活及自噬促进作用
5. 低剂量腺苷磷酸A增强LIPUS诱导的钙活化及其对软骨细胞的保护作用
研究表明,细胞外Ca²⁺对启动软骨细胞自发钙振荡至关重要,而内质网(ER)中Ca²⁺的释放对钙振荡也必不可少,其中磷脂酶C-肌醇1,4,5-三磷酸(PLC-IP3)通路在自发钙振荡的启动中起关键作用,因此,为了尝试寻找联合治疗的策略,作者使用外源性IP3受体(IP3R)特异性激动剂腺苷磷酸A(Adenophostin A,AdA)联合LIPUS处理软骨细胞(LIPUS组;AdA组;LIPUS+AdA组),钙成像结果显示:LIPUS+AdA组的钙振荡比单独使用LIPUS或AdA更显著,并且LIPUS+AdA组的钙峰数量、幅度和细胞响应率均更高,由此表明,AdA与LIPUS在激活软骨细胞钙信号方面具有协同效应。此外,WB结果显示:LIPUS上调了软骨细胞LC3 II的表达,低剂量AdA单独处理也有类似效果,而两者联用后这一作用显著增强。并且WB和免疫荧光结果一致表明,LIPUS联合低剂量AdA能进一步增加Collagen II的表达,同时降低MMP-13的表达,说明这种联合策略能进一步增强LIPUS对细胞外基质的合成促进作用。
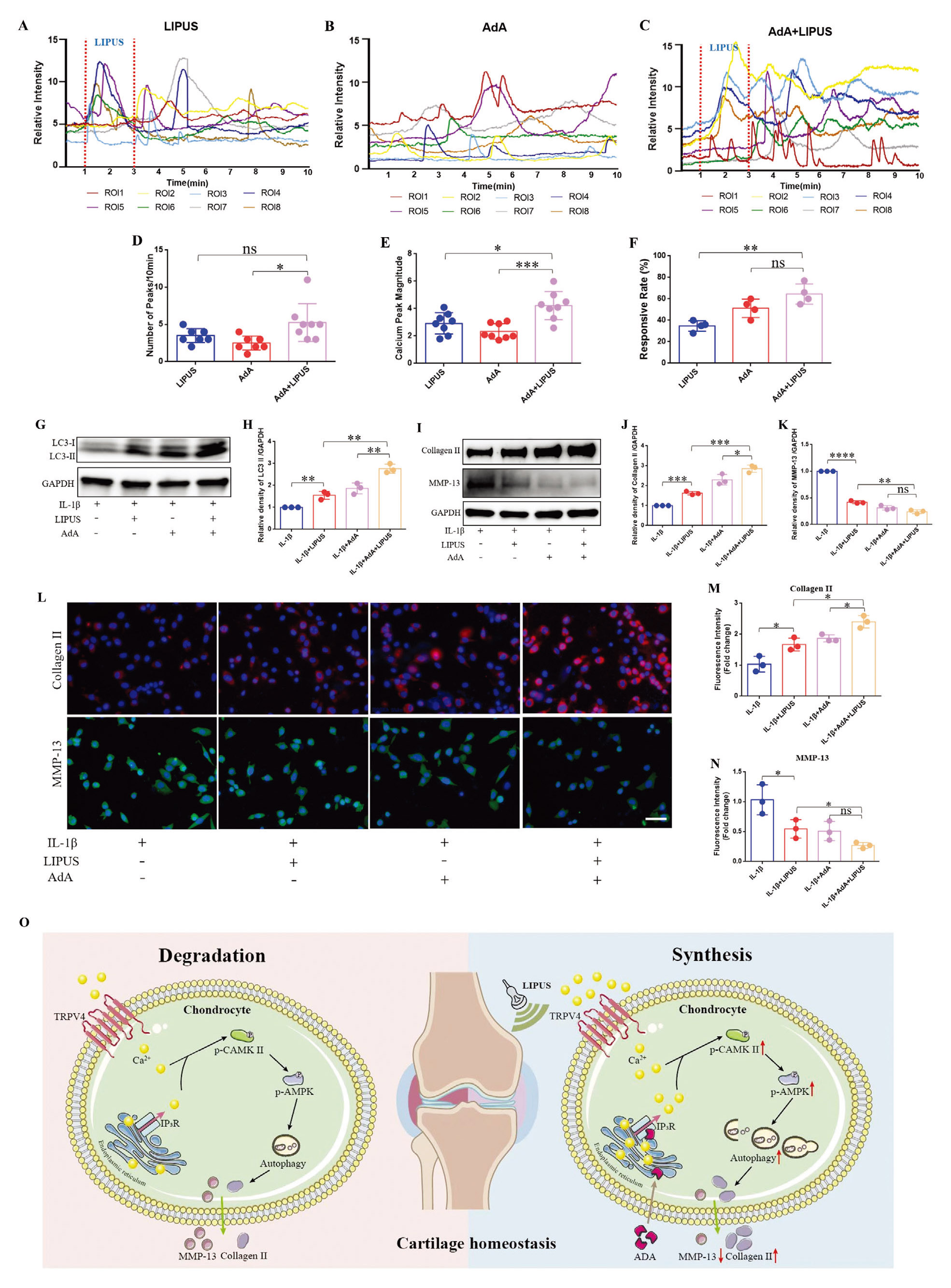
图6. 低剂量腺苷磷酸A增强LIPUS诱导的钙活化及其对软骨细胞的保护作用
总结
综上所述,本研究表明: LIPUS通过激活软骨细胞钙信号通路,以钙依赖性方式促进软骨细胞自噬,从而缓解骨关节炎进展。研究进一步揭示机械敏感性离子通道TRPV4是LIPUS调控软骨细胞功能的关键介质,基于上述机制,作者开发了联合药物治疗新策略,为生物力学干预治疗骨关节炎提供了创新性治疗思路。

查看更多

查看更多

查看更多

联系我们

返回顶部