查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
CRISPR-dCas9系统作为基因编辑领域的革命性工具,无需切割DNA即可精准调控内源基因的表达,在疾病治疗中展现出巨大的潜力。然而,其临床应用始终受限于时空控制这一难题。传统的外部调控策略面临根本性挑战:化学诱导剂(如雷帕霉素)难以清除且会干扰关键信号通路(如mTOR信号),而光控系统则因组织穿透性差与细胞光毒性难以实现深层组织调控,使得脱靶效应与系统安全风险难以克服。突破瓶颈的关键在于寻找可靠的内源性调控分子。miRNA在特定生物学背景下呈现的时空特异性表达模式,与细胞状态及疾病进程紧密相关,为基因编辑系统活性的精确时空调控提供了实现的可行性。

2025年3月24日,西安交通大学王福教授团队在《ACS Nano》(IF=15.8)上发表题为“Toehold-Based CRISPR-dCas9 Transcriptional Activation Platform for Spatiotemporally Controllable Gene Therapy in Tumor and Diabetic Mouse Models”的研究论文。本研究旨在开发一种细胞特异性miRNA响应型CRISPR-dCas9转录激活系统(命名为mCTA),通过创新性连接toehold基因开关以调控dCas9-VPR的表达。Toehold开关具有miRNA特异性,当目标miRNA存在时,toehold开关被激活,解除对dCas9-VPR的转录抑制,进而启动mCTA系统;反之,则系统关闭。在应用上,mCTA系统实现了双重突破:一方面利用细胞特异性内源miRNA实现了对CRISPR-dCas9系统的精确调控,规避了传统外部调控策略的缺陷;另一方面建立了多功能平台,既可应用于示踪发育过程中miRNA的动态变化,又能在动物水平精准激活下游功能基因的表达,实现肿瘤治疗与血糖水平的改善,为将来应用于生物医学成像与基因治疗领域奠定了基础。
汉恒生物有幸为作者提供了本研究所用的sgRNA,为mCTA系统工具的成功激活提供了帮助。
下面我们一起来看看作者是如何构建并验证mCTA系统的:
一、mCTA基因激活系统设计
作者设计的mCTA系统,其原理是由toehold开关调控dCas9-VPR的表达(图1)。Toehold开关是一种特殊的茎环结构,通过设计特定miRNA互补序列形成“基因锁”。当目标miRNA存在时,其作为“密钥”与toehold结合,使系统进入“开启”状态,dCas9-VPR可正常表达并在sgRNA的引导下结合到7*TRE序列,进而调控下游目的基因的转录。反之,当目标miRNA缺失时,toehold保持锁定状态,阻断dCas9表达使系统关闭。
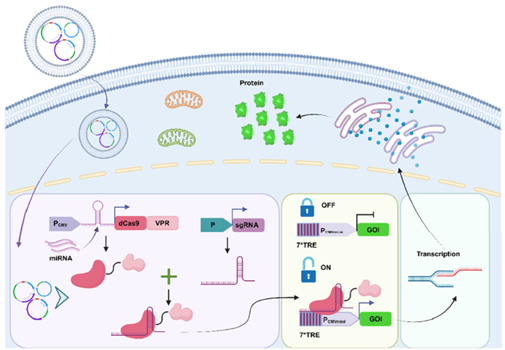
图1. mCTA系统示意图
二、 mCTA基因激活系统的特性及优化
接着,作者通过一系列实验验证证实并优化了mCTA系统。首先,在293 T细胞中构建了可响应miR-21的m21CTA系统,以萤火虫荧光素酶(Fluc)作为下游报告基因,设置三组对比实验,结果证实了该系统的成功构建及特异性(图2 A-C):
(1)不含toehold开关的CTA组,可持续表达dCas9-VPR,显示较强Fluc信号;
(2)含toehold开关的m21CTA组,因dCas9-VPR表达被抑制而导致Fluc信号显著降低;
(3)共转染外源miR-21的m21CTA组,成功提高Fluc信号。
作者为测试不同的质粒添加比例对m21CTA系统的影响,在总质粒量恒定的条件下,设置了五种不同比例的质粒组合。结果发现,当PdCas9-VPR : PTRE-Fluc : PsgRNA质粒比例为2:2:1时,外源miR-21介导的系统激活倍数最高(5.5倍),因此后续所有实验均以此比例进行(图2 D,E)。另外,经浓度梯度实验证实,Fluc活性随外源miR-21浓度的增加而增强(图2 F)。为进一步验证mCTA系统的普适性,同样构建了针对miR-9的m9CTA系统,并证实了miR-9对m9CTA系统的激活也具有浓度依赖性和特异性(图2 G,H)。此外,在具有内源性高表达miR-21和极低表达miR-9的4T1细胞中评估了m21CTA系统和m9CTA系统,与对照质粒PTRE-Fluc相比,m21CTA系统的Fluc信号显著提升29.42倍,而m9CTA系统则信号微弱(图2 I),这一发现与293T细胞中获得的数据结论一致。
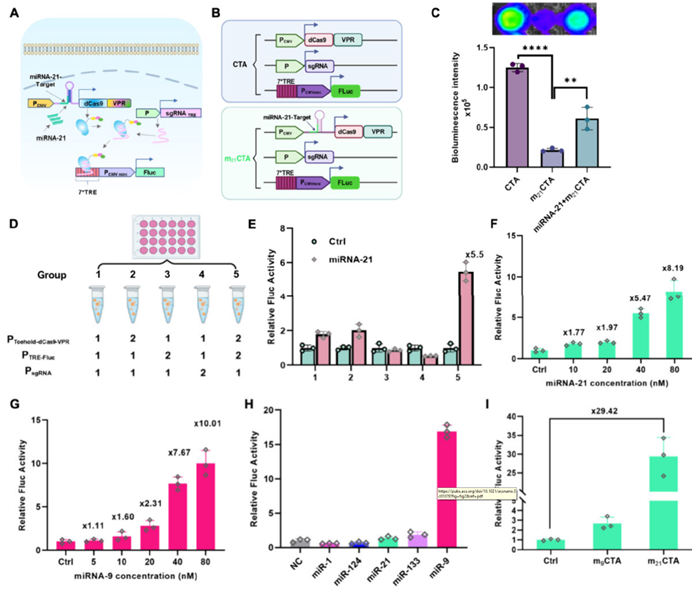
图2. 哺乳动物细胞中mCTA系统的验证与优化
三、利用mCTA系统对细胞内源性miRNA动态表达进行活体成像监测
为了探究mCTA系统对内源性miRNA表达的动态监测效果,作者建立了P19细胞神经分化模型。随着分化天数的增加,通过共聚焦显微镜观察到神经标志物MAP2的表达呈上升趋势,表明分化细胞模型构建成功,且qPCR检测证实miR-9的表达同步上调(图3 A-C)。随后,将m9CTA系统转染至分化的P19细胞中,发现Fluc信号随分化进程加快而逐渐增强。进一步将细胞移植至小鼠体内进行活体成像检测,也观察到了相同的现象。这些结果表明m9CTA系统能有效可视化监测神经分化过程中miR-9的动态变化(图3 D-F)。
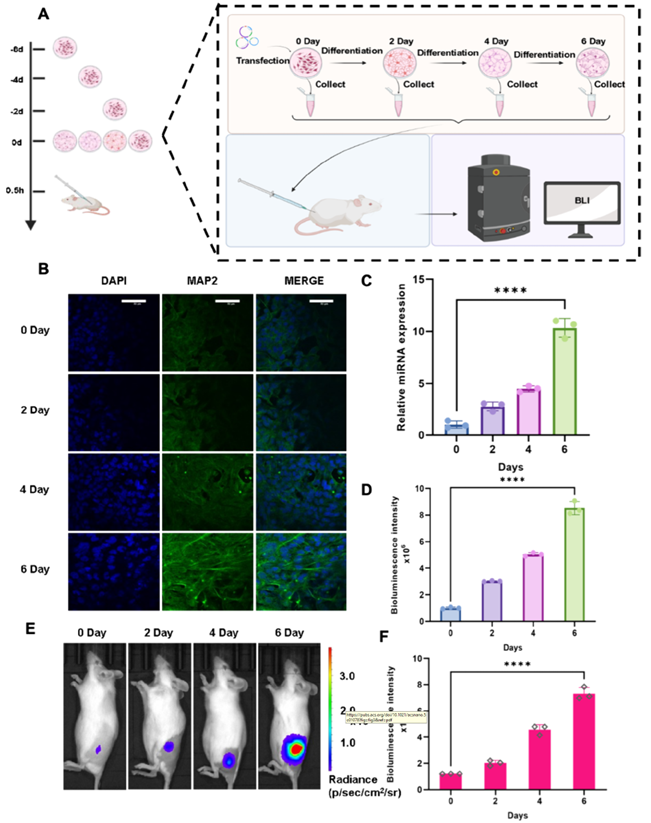
图3. 利用mCTA系统对miR-9进行活体成像
为验证mCTA系统在深部组织的成像能力,研究转向小鼠肝脏动物模型。经尾静脉流体动力学注射向小鼠肝脏递送mCTA系统,结果发现仅当外源miR-21 mimics与m21CTA系统同时注射时,小鼠肝脏才显示出强Fluc信号;进一步构建肝脏特异性miR-122响应的m122CTA系统,当该系统递送至小鼠肝脏时,因肝脏内源性高表达miR-122呈现出显著的Fluc信号,而m9CTA组则信号微弱(图4)。这些发现不仅证实了mCTA系统的深部组织成像能力,更为miRNAs动态监测提供了实用型工具。
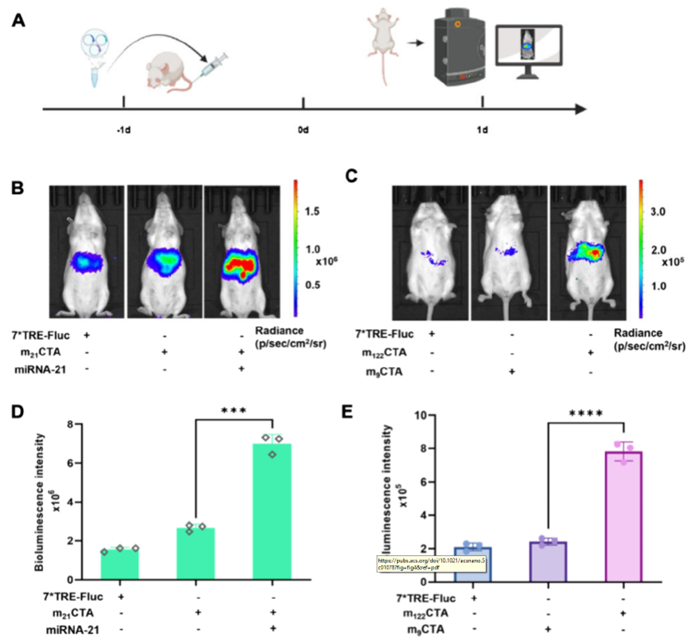
图4. 验证mCTA系统的深层组织成像能力
四、探索mCTA系统在癌症治疗中的能力
除了对mCTA系统的成像功能研究外,作者还将mCTA系统的下游基因Fluc替换为白喉毒素A片段(DTA),旨在通过肿瘤微环境内源miRNA的特异性激活系统实现靶向治疗(图5 A)。在高表达miR-21的4T1细胞中,与单独转染P7*TRE-DTA或m122CTA系统相比,转染m21CTA系统可显著诱导细胞凋亡、抑制细胞迁移(图5 B-E)。随后,在异种移植瘤模型中验证mCTA系统在体内对肿瘤的治疗效果,结果发现m21CTA对肿瘤生长具有显著的抑制作用,且不影响小鼠的体重(图5 F-I)。由此证实,mCTA系统可转化为一种基于内源miRNA精准调控的肿瘤治疗工具。
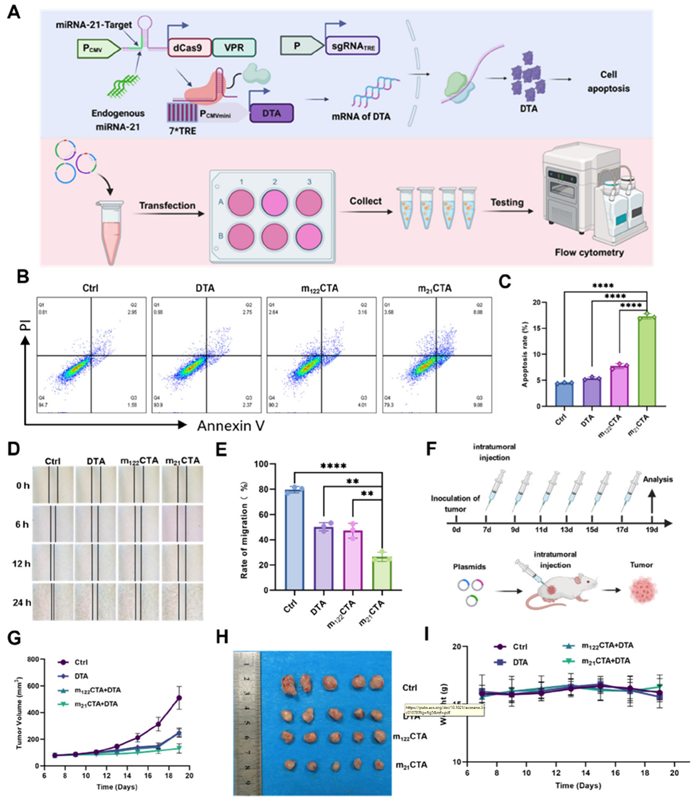
图5. m21CTA系统在肿瘤治疗中的应用
五、探讨mCTA系统通过激活PDX-1基因治疗糖尿病的应用
作者进一步探讨了mCTA系统在代谢性疾病治疗中的潜力。针对1型糖尿病(T1D)因胰岛β细胞破坏而导致的胰岛素绝对缺乏,作者设计了基于肝脏特异性的m122CTA系统,该系统核心是通过激活肝细胞内源性PDX-1基因(胰腺发育关键因子),从而将肝细胞转化为胰岛β细胞(图6 A,B)。为此,采用链脲佐菌素(STZ)构建了小鼠T1D模型,通过多项指标验证了模型的可靠性:体重下降、胰岛素分泌显著减少、胰岛β细胞严重受损,且ALT、CHO、CR水平显著升高(图6 C-H)。但经m122CTA系统治疗后,小鼠模型的血糖指数显著降低(图6 I)。这一结果表明,mCTA系统具有治疗T1D的潜力。
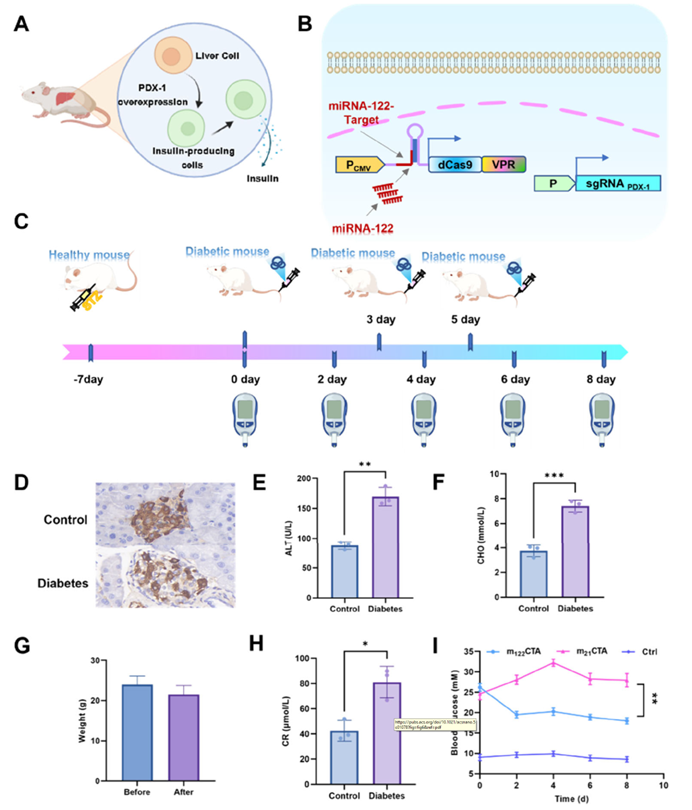
图6. m122CTA系统在糖尿病小鼠模型中的治疗应用
本研究成功开发了一类可定制的miRNA调控CRISPR-dCas9系统—mCTA,利用细胞特异性内源miRNA实现靶基因激活的时空精准调控。该系统兼具实时动态成像监测内源miRNA变化的功能,以及治疗癌症和糖尿病的潜力。mCTA可作为一种通用策略,适配其他CRISPR-Cas系统,以推动精准基因治疗的发展,未来必将在多种疾病的基因治疗中取得重大进展。
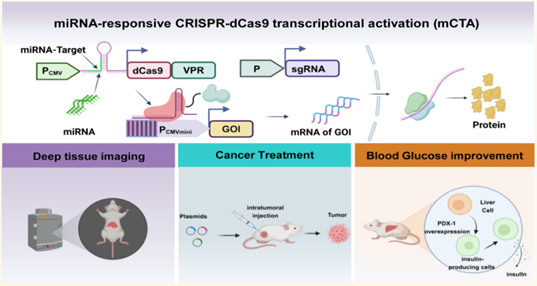
图形摘要:mCTA系统及其应用

查看更多

查看更多

查看更多

联系我们

返回顶部