查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
矽肺是一种由吸入二氧化硅(SiO₂)颗粒引起的慢性、进行性肺部疾病,其特征是肺组织中胶原蛋白沉积和纤维化,目前仍然缺乏有效的治疗手段。有研究表明,单核细胞衍生的巨噬细胞 (Monocyte-derived macrophages,MoMac) 是导致肺纤维化最重要的效应细胞,然而,矽肺中MoMac的分化特征及其影响肺纤维化进展的机制尚不清楚。

2025年5月19日,首都医科大学王辰院士、代华平教授在《Cellular & Molecular Immunology》杂志上在线发表了题为“Targeting Lp-PLA2 inhibits profibrotic monocyte-derived macrophages in silicosis through restoring cardiolipin mediated mitophagy”的研究报告,揭示了Lp-PLA2-ALCAT1-CL通路在矽肺发展过程中的作用机制,这一发现为开发针对肺纤维化的新型治疗策略提供了理论依据和数据支持。值得注意的是,在本研究中,作者使用了汉恒生物提供的自噬双标腺病毒工具(mRFP-EGFP-LC3B)来观察自噬体以及自噬溶酶体的形成。

接下来,让我们一起来了解一下这篇文章吧。
通过scRNA-Seq和ST-seq分析硅肺中巨噬细胞簇和组织微环境的异质性
首先,通过对接受支气管滴注SiO2后3、7、14、28和56天或PBS(0天)的硅肺小鼠的肺细胞进行scRNA-seq分析,确定了五个巨噬细胞亚群:TRAM、MertkhiMac、Spp1hiMac、S100a8/9hiMac和recMac。其中,Spp1hiMacs 呈现出与损伤和炎症反应、IL-1β 分泌、胶原合成、转化生长因子-β(TGF-β)信号通路以及平滑肌细胞增殖密切相关的促纤维化基因高表达特征。在矽肺病进展过程中,Spp1hiMacs的比例随着疾病发展持续增加,并主要局限于纤维化微环境。鉴于矽肺巨噬细胞亚群的比例及定位特点,后续重点研究Spp1hiMac亚群。
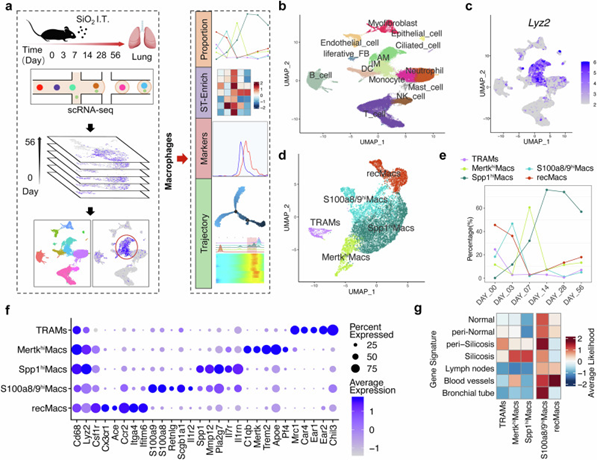
图1. 通过scRNA-Seq 和 ST-seq 分析硅肺中巨噬细胞簇和组织微环境的异质性
Spp1hiMacs 处于未成熟分化状态,并在矽肺进展过程中获得促纤维化的潜力
对所有样本巨噬细胞的拟时间分析显示,Spp1hiMacs表现出持续性增加,这表明肺组织对Spp1hiMacs的重塑程度更大。Spp1hiMac标志基因(Spp1、Mmp12、Pla2g7、Il7r和Il1rn)的表达水平在SiglecFloAMs中高于SiglecFhiAms,这表明Spp1hiMacs与SiglecFloAMs具有相似的特性,并表现出类似的未成熟分化特征。在矽肺病进展过程中,SiglecFhiAMs的比例下降,SiglecFloAMs的比例上升,这一趋势与通过单细胞RNA测序(scRNA-seq)分析观察到的TRAMs和SpphiMacs的趋势一致。
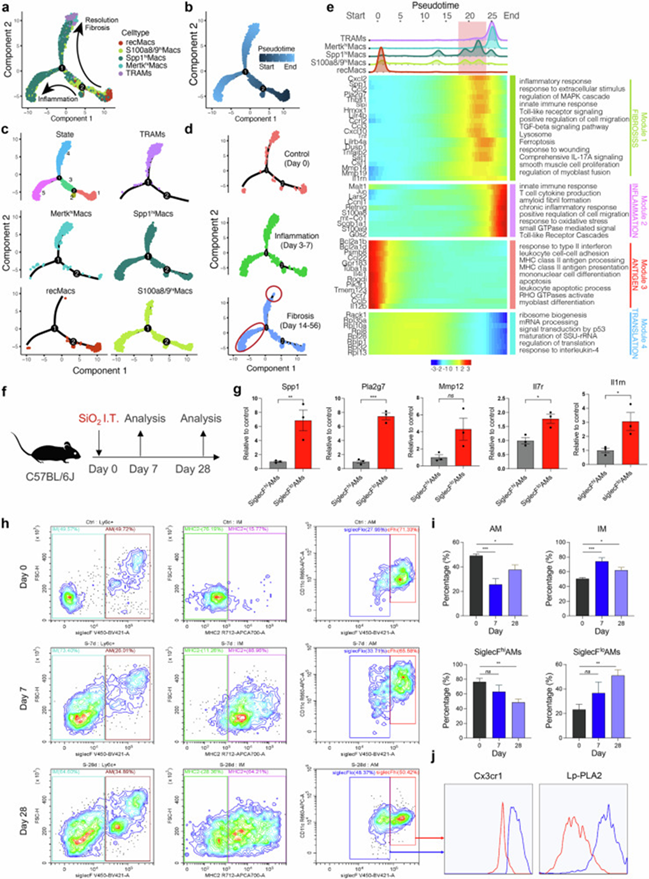
图2. Spp1hiMacs 处于未成熟分化状态,并在矽肺进展过程中获得促纤维化的潜力
Pla2g7基因的持续表达对硅肺小鼠中Spp1hiMacs的促纤维化机制至关重要
将硅肺纤维化微环境的数据与巨噬细胞分化数据进行整合,最终筛选出11个关键基因 (Pla2g7、Spp1、Gpnmb、Cd68、Hmox1、Slpi、Ctsb、Ctsd、Tnfaip2、Psap和Lgals3)。对纤维化微环境中高表达基因的蛋白质-蛋白质相互作用(PPI)网络进行分析,识别出Pla2g7是一个富集于脂质代谢和炎症相关功能的枢纽基因。免疫荧光检测到其表达的Lp-PLA2蛋白在硅肺小鼠的纤维化区域中与巨噬细胞标志物CD68共表达,此外,也观察到Lp-PLA2与Cx3cr1和Siglec F在硅肺患者的纤维化肺组织中共定位。流式分析发现,SiglecFloAMs中的Lp-PLA2表达水平高于SiglecFhiAMs。单细胞RNA测序分析显示,在从正常状态向炎症状态再向纤维化状态的转变过程中,Spp1hiMacs中Pla2g7基因的表达水平上调。这些发现突显了Pla2g7在调节巨噬细胞分化和矽肺相关纤维化中的关键作用。
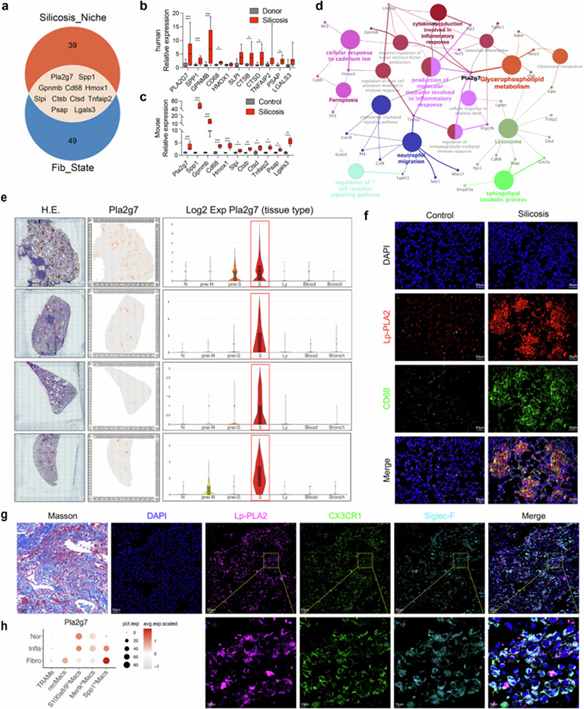
图3. Pla2g7基因的持续表达对硅肺小鼠中Spp1hiMacs的促纤维化机制至关重要
巨噬细胞特异性Pla2g7基因敲除对小鼠矽肺纤维化和巨噬细胞亚群的影响
作者构建了巨噬细胞特异性敲除Pla2g7基因的转基因小鼠CreLyz2Pla2g7flox/flox,并进行微CT、HE染色和Masson染色检测,发现CreLyz2Pla2g7flox/flox小鼠的肺部纤维化结节、炎症浸润和胶原沉积减少,同时纤维化标志物表达降低。流式分析也观察到CreLyz2Pla2g7flox/flox小鼠肺部浸润巨噬细胞中促纤维化SiglecFloAM亚群减少,表明Pla2g7在调节巨噬细胞功能及参与矽肺病诱导的纤维化过程中发挥关键作用。
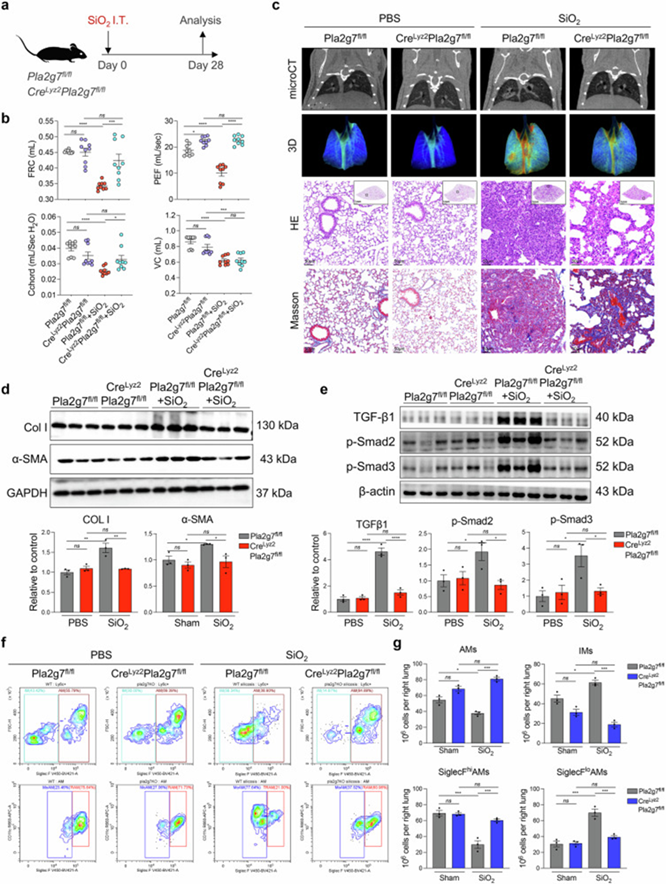
图4. 巨噬细胞特异性Pla2g7基因敲除对小鼠矽肺纤维化和巨噬细胞亚群的影响
Pla2g7基因缺失抑制硅肺小鼠及SiO₂诱导的巨噬细胞分化
极化代表巨噬细胞的激活和功能执行,其中M1和M2极化对矽肺病的发生发展具有重要作用。ScRNA-seq分析显示,Spp1hiMacs与M2极化的相关性最强。免疫染色发现,在纤维化小鼠肺组织中,Lp-PLA2与肿瘤坏死因子α(TNF-α)和精氨酸酶1(Αrg1)存在强共表达,而TNF-α和Αrg1是M1和M2极化的标志物。流式细胞术分析显示,与Pla2g7fl/fl小鼠相比,SiO₂诱导后CreLyz2Pla2g7fl/fl小鼠肺部M1巨噬细胞(CD11c+ CD206-)和M2巨噬细胞(CD11c- CD206+)的比例显著降低。Western blot实验结果显示CreLyz2Pla2g7fl/fl小鼠肺组织中诱导型一氧化氮合酶(iNOS)、IL-1β、Arg1和IL-10的表达显著降低。此外,SiO₂诱导的小鼠骨髓衍生巨噬细胞(BMDMs)中iNOS、IL-1β、Arg1和IL-10的表达水平以及Stat6的磷酸化水平显著升高,而Pla2g7沉默可抑制这一过程。然而,OE-Pla2g7与SiO₂在MoMac细胞系RAW264.7中协同作用,促进M1和M2极化。此外,SiO₂刺激的BMDMs和OE-Pla2g7转染的RAW264.7细胞诱导了在共培养的MLE12细胞(通过上皮-间质转化(EMT))和小鼠原代成纤维细胞(通过成纤维细胞-肌成纤维细胞转化(FMT))的肌成纤维细胞表型,而沉默Pla2g7的BMDMs则抑制相关表型。
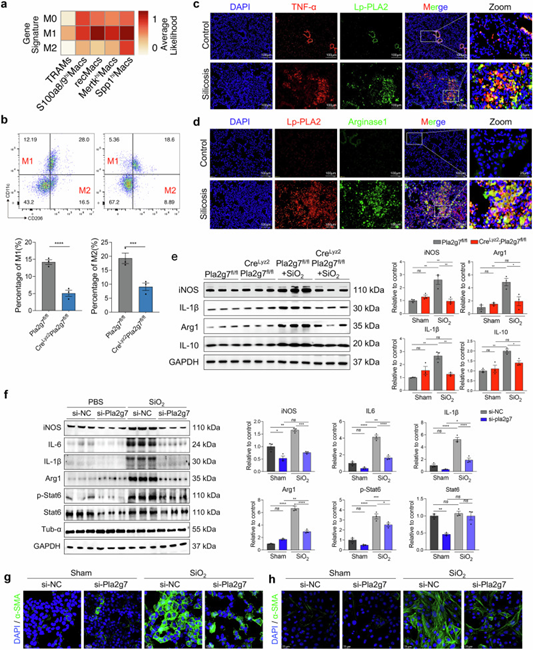
图5. Pla2g7基因缺失抑制硅肺小鼠及SiO₂诱导的巨噬细胞分化
Lp-PLA2在SiO₂诱导的MoMacs中被转运至线粒体,并促进细胞膜重塑,导致线粒体功能障碍
Lp-PLA2作为一种磷脂酶酶,通过催化脂质代谢来调节炎症。ST 生态位富集分析显示,脂质代谢通路在肺纤维化生态位中显著富集。矽肺患者肺泡灌洗液中巨噬细胞亚群数量的增加也导致脂质代谢异常。随后对矽肺组织中分离的巨噬细胞进行脂质组学分析,发现CL代谢存在显著异常,表现为乙酰化水平和不饱和度升高。CL在赖氨酸心磷脂酰基转移酶1(ALCAT1)作用下发生异常酰化及不饱和化,使CL更易发生氧化。CL是维持线粒体稳态的必需脂质,Lp-PLA2作为催化CL氧化和水解的关键酶,提示SiO₂诱导的巨噬细胞表型改变可能涉及Lp-PLA2对ALCAT1-CL代谢通路的调控作用及线粒体功能障碍。
WB分析显示,SiO₂诱导的巨噬细胞线粒体内Lp-PLA2和ALCAT1的表达上调。免疫染色结果显示Lp-PLA2与线粒体标志物COX IV共定位。透射电子显微镜(TEM)显示,对照组小鼠的巨噬细胞线粒体结构正常,而矽肺小鼠的线粒体则呈现肿胀和空泡化。敲低Pla2g7抑制了ALCAT1蛋白水平的升高,同时维持了SiO₂诱导的巨噬细胞线粒体膜电位并降低了线粒体活性氧(mtROS)水平。Pla2g7过表达则导致线粒体膜电位降低和mtROS水平升高,这一效应可通过si-ALCAT1转染及CL过氧化物酶抑制剂SS-31处理恢复。此外,过表达Pla2g7的巨噬细胞表现出线粒体融合相关蛋白视神经萎缩1型(OPA1)和线粒体融合蛋白2(MFN2)的表达下降,以及线粒体分裂相关蛋白动力蛋白1(DRP1)和分裂蛋白1(FIS1)的表达增加,这些变化可通过沉默ALCAT1得到缓解,说明了Pla2g7在线粒体功能中的关键作用。
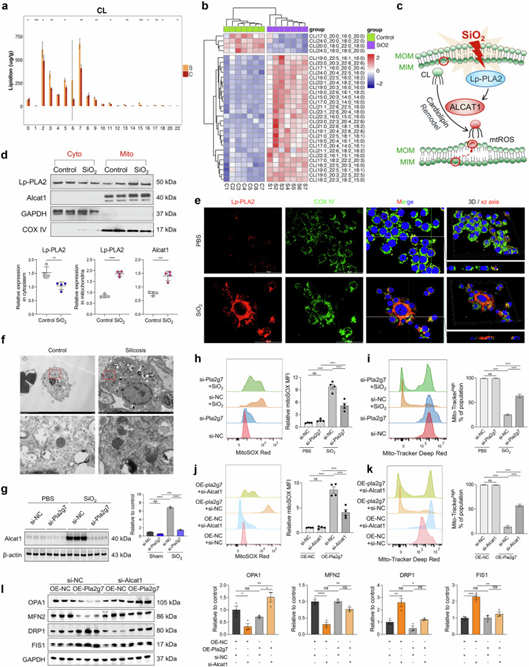
图6. Lp-PLA2 在SiO₂诱导的 MoMacs 中被转运至线粒体,并促进细胞膜重塑,导致线粒体功能障碍
Lp-PLA2-CL通路在SiO₂诱导的巨噬细胞及SiglecFloAM中诱导线粒体自噬功能障碍
线粒体自噬对线粒体质量控制至关重要。作者通过全细胞蛋白分析发现,在SiO₂刺激或OE-Pla2g7转染后,巨噬细胞内的蛋白泛素化水平和LC3II水平均升高。线粒体损伤标志物外线粒体膜转运蛋白20(TOM20)和细胞色素C的表达也上调。抑制Lp-PLA2 或 ALCAT1 可增加 LC3II 的表达水平。作者又通过转染EGFP-mRFP-LC3腺病毒来评估线粒体自噬的完整性,结果显示SiO2诱导和OE-Pla2g7转染后自噬体-溶酶体融合受损,这一现象可通过Pla2g7和ALCAT1沉默得到缓解。使用自噬体-溶酶体融合抑制剂巴弗霉素A1 (Baf A1)和氯喹处理,结果发现可削弱CreLyz2Pla2g7flox/flox小鼠的抗纤维化能力,导致肺组织中TOM20、细胞色素C、 I型胶原蛋白和α平滑肌肌动蛋白的表达。此外,SiO₂诱导的CreLyz2Pla2g7flox/flox小鼠肺组织中SiglecFloAMs的比例低于SiO₂诱导的Pla2g7flox/flox小鼠。然而,SiO₂诱导的CreLyz2Pla2g7flox/flox小鼠在接受Baf A1治疗后,SiglecFloAMs的比例有所增加。
研究还发现编码溶酶体半胱氨酸蛋白酶B(Cathepsin B)的Ctsb基因在Pla2g7high细胞中高度表达。Cathepsin B在溶酶体完整时可降解溶酶体内容物,然而,当溶酶体受损时,Cathepsin B会转运至细胞质,影响自噬流和TGF-β1的激活。在本研究中,发现敲除Pla2g7基因的矽肺小鼠中Cathepsin B的表达水平显著降低。随后对Cathepsin B和溶酶体标记蛋白Lamp1的检测显示,在OE-NC转染的巨噬细胞中,Lamp1与Cathepsin B共定位,而在OE-Pla2g7转染的巨噬细胞中,Lamp1水平下降,Cathepsin B分散于细胞质中,这一现象可通过沉默ALCAT1逆转。这些结果表明,矽肺病过程中巨噬细胞的溶酶体损伤至少部分由Lp-PLA2-ALCAT1通路调节。此外,Pla2g7和ALCAT1的沉默抑制了SiO₂刺激的和OE-Pla2g7转染的RAW264.7细胞中Cathepsin B的增加以及TGF-β-Smad2/3通路的激活。这些结果表明,ALCAT1-Lp-PLA2通路破坏了线粒体自噬的完整性,从而通过调节溶酶体损伤来扰乱自噬流。
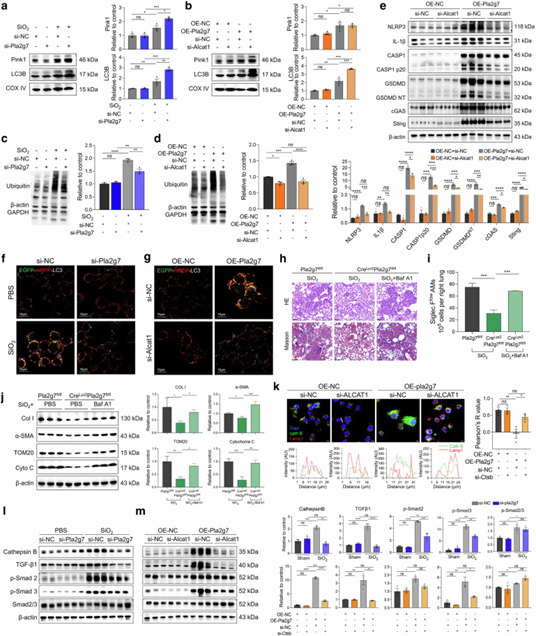
图7. Lp-PLA2-CL通路在SiO₂诱导的巨噬细胞及SiglecFloAM中诱导线粒体自噬功能障碍
Lp-PLA2特异性口服抑制剂达拉普拉迪布可保护小鼠免受SiO₂暴露引起的肺纤维化
最后,通过一项随机对照试验,作者评估了口服Lp-PLA2特异性抑制剂达拉普拉迪布(darapladib)对SiO₂诱导的小鼠肺纤维化的疗效。研究结果显示,暴露于SiO₂后接受darapladib治疗的小鼠,其肺功能显著改善,且肺纤维化程度较溶剂对照组明显减轻。WB分析显示,SiO₂+darapladib达拉普拉迪布组小鼠肺组织中纤维化蛋白(I型胶原、α-SMA和TGF-β1)及炎症蛋白(iNOS、Arg1、IL-1β和IL-6)的表达水平显著低于SiO₂组,类似结果也通过ELISA获得。此外,脂质组学结果进一步表明,达拉普拉迪布阻碍了CL的酰化和不饱和化。
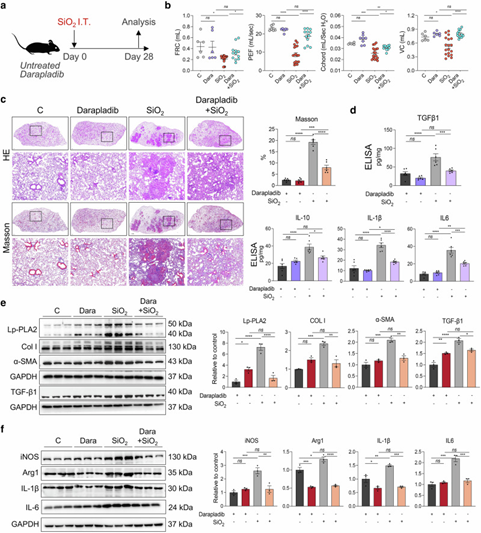
图8. Lp-PLA2特异性口服抑制剂达拉普拉迪布可保护小鼠免受SiO₂暴露引起的肺纤维化
综上所述,该研究揭示了矽肺中单核来源巨噬细胞通过Lp-PLA2-ALCAT1-CL通路介导线粒体自噬缺陷,进而分化为促纤维化表型的机制,并证实Darapladib通过恢复心磷脂代谢和线粒体自噬抑制纤维化。这不仅深化了对矽肺发病机制的理解,也为其治疗提供了理论框架。

查看更多

查看更多

查看更多

联系我们

返回顶部