查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
烧伤创面愈合是临床面临的重大挑战,全球每年约18万人因此死亡,且治疗费用高昂。与普通创面相比,烧伤创面微环境更为复杂,其特征性的氧化应激状态会损害线粒体功能、抑制角质形成细胞迁移并引发持续的炎症反应,严重阻碍了上皮化进程。尽管生长因子疗法和生物敷料等现有治疗手段已取得了一定的成效,但普遍存在药物突释、滞留性差、易降解等问题,加之氧化应激微环境对表皮细胞功能的抑制作用,临床疗效受到了显著限制。近年来,miRNA在氧化应激相关疾病中展现出治疗潜力,但针对烧伤创面的研究仍属空白,且游离miRNA易被核酸酶降解的特性制约了其在临床的应用。虽然外泌体可作为miRNA递送载体,但其存在创面滞留时间不足的局限;而新兴的MXene纳米材料兼具抗氧化、抗炎和增强复合材料的机械性能等特点,为水凝胶敷料的改进提供了新思路。因此,鉴定调控上皮化的关键miRNA,并开发基于MXene复合水凝胶的靶向递药系统,对突破当前烧伤治疗瓶颈具有重要的科学意义。

2025年6月11日,海军军医大学夏照帆院士团队在《Bioactive Materials》(IF=20.3)上发表题为“AntagomiR-192-5p-engineered exosomes encapsulated in MXene-modified GelMA hydrogel facilitated epithelization of burn wounds by targeting OLFM4”的研究论文。本研究通过高通量测序筛选发现miR-192-5p在氧化应激的人永生化角质形成细胞(HaCaT细胞)模型和烧伤创面组织中显著上调,并证实其通过抑制OLFM4的表达而损害HaCaT细胞的增殖、迁移能力并促进细胞凋亡。接着,研究团队成功构建了负载antagomiR-192-5p(ant-192)的工程化外泌体(Exo-ant-192),并进一步将其封装于由GelMA和MXene纳米片组成的复合水凝胶中,开发出多功能敷料Exo-ant-192@M-Gel。该体系不仅实现了ant-192的持续释放和延缓降解,还展现出显著的抗炎特性,有效改善了烧伤创面微环境并加速上皮化进程。该治疗策略通过miR-192-5p/OLFM4轴显著促进表皮细胞功能,为烧伤创面愈合提供了新型靶向治疗方法和药物递送平台。
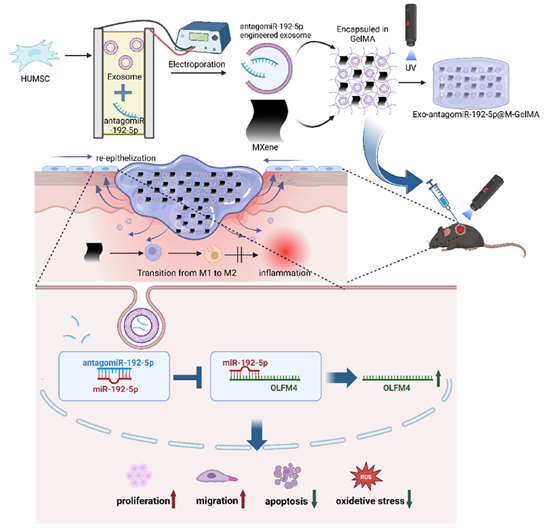
Exo-ant-192@M-Gel制备流程及促进烧伤愈合示意图
汉恒生物有幸为作者提供了针对OLFM4基因的siRNA,成功敲低了其在HaCaT细胞中的表达,阐明了miR-192-5p在烧伤创面愈合中的作用机制。
下面我们一起来看看作者是如何进行鉴定和开发的:
1. 在HaCaT细胞氧化应激模型及烧伤创面中,miR-192-5p表达水平显著上调
为鉴定HaCaT细胞在氧化应激过程中起关键作用的miRNAs,作者使用0.6 mmol/L H2O2处理12小时以建立HaCaT细胞氧化应激模型,并通过高通量测序进行分析。结果发现,氧化应激细胞模型中有24个差异表达的miRNA,其中miR-192-5p因基线表达水平最高且上调倍数较高(上调2.27倍)被作为候选基因进行后续的验证;同时,qPCR结果证实了这点(图1 A-E)。进一步对组织进行检测发现,在伤后第6天的烧伤创面边缘组织中miR-192-5p的表达量较全层皮肤缺损创面更高(高1.7倍)(图1 F)。综上,提示miR-192-5p可能与氧化应激及烧伤创面愈合缓慢有关。
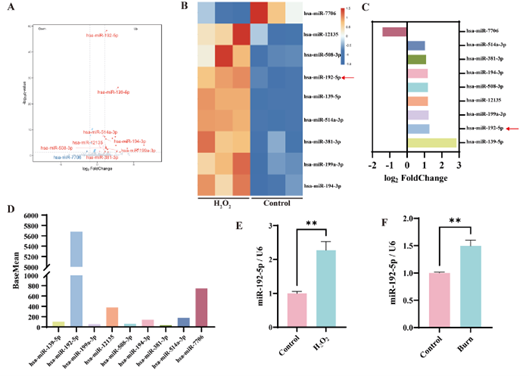
图1. 功能性miRNA的鉴定与筛选
2. 过表达miR-192-5p会抑制正常伤口愈合,敲低则可促进体内烧伤创面的愈合
作者通过在C57BL/6小鼠中建立全层皮肤缺损和烧伤模型,探究了miR-192-5p对创面愈合的影响。结果显示,在全层皮肤缺损模型中,通过创面边缘注射ago-192来过表达miR-192-5p会显著抑制创面愈合,并延缓上皮再生(图2 A-D);而在烧伤模型创面边缘注射ant-192来抑制miR-192-5p,则显著促进创面愈合,同时加速上皮再生(图2 E-H)。
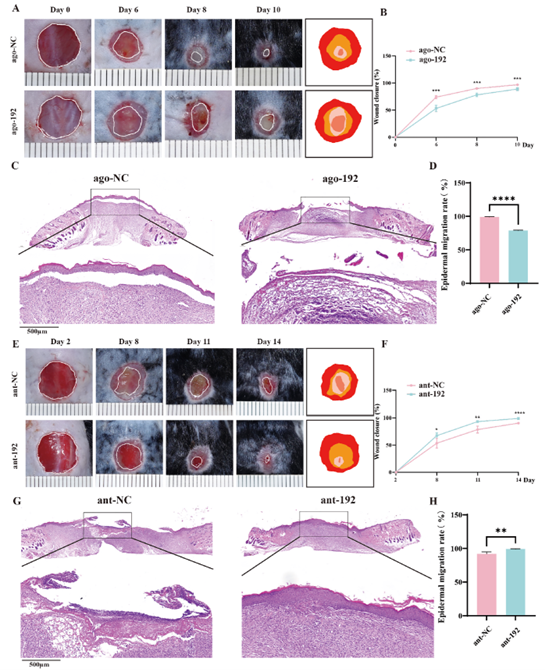
图2. 在体内研究miR-192-5p对伤口愈合的影响
3. 过表达miR-192-5p抑制了HaCaT细胞的增殖和迁移,同时促进其凋亡及ROS生成;相反,则可逆转氧化应激诱导的HaCaT细胞功能抑制。
接着,作者通过多种细胞功能实验系统评估了miR-192-5p对HaCaT细胞活性的影响,包括细胞增殖、迁移、凋亡及氧化应激反应。使用miR-192-5p mimic转染HaCaT细胞后,CCK-8实验结果显示细胞活力明显下降,划痕实验证实迁移能力减弱,而Annexin V-FITC/PI染色结合流式检测显示细胞凋亡率升高,DCFH-DA染色表明ROS生成增加(图3)。
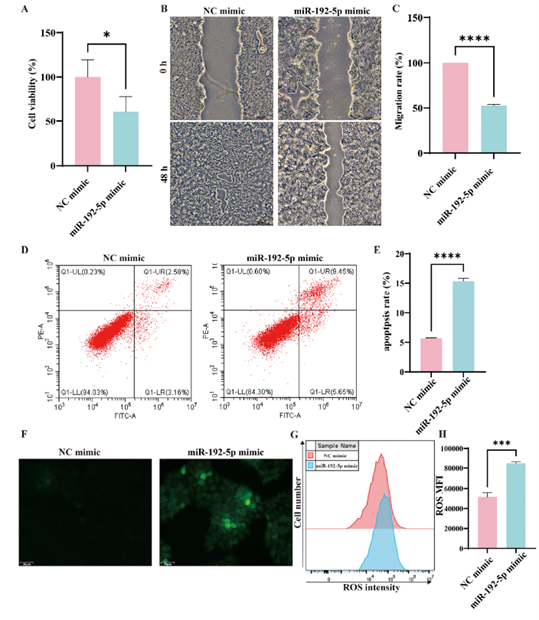
图3. miR-192-5p抑制HaCaT细胞增殖与迁移,并促进细胞凋亡及氧化应激
相反,在氧化应激条件下,使用inhibitor抑制miR-192-5p表达能够逆转这些效应(图4)。这些结果表明,miR-192-5p主要通过影响表皮细胞功能参与伤口修复过程。
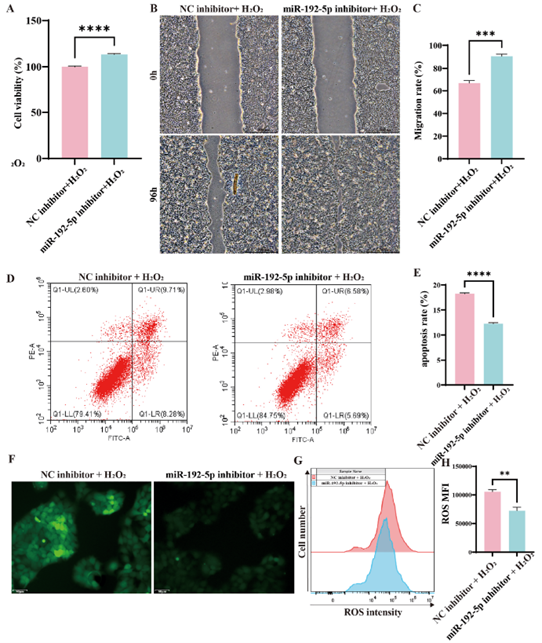
图4. 氧化应激条件下,敲低miR-192-5p对HaCaT细胞功能的影响
4. miR-192-5p通过靶向OLFM4调控HaCaT细胞功能
为阐明miR-192-5p在HaCaT细胞中的调控机制,作者在HaCaT细胞中过表达miR-192-5p后进行转录组测序分析。结果发现,过表达miR-192-5p可导致HaCaT细胞中286个基因差异表达,并通过与miRWalk数据库预测靶基因进行交集分析,锁定OLFM4作为关键候选基因(图5 A-C)。双荧光素酶报告实验证实miR-192-5p可直接结合OLFM4 mRNA的3’UTR区;此外,qPCR、免疫荧光和WB验证了miR-192-5p过表达会显著降低OLFM4的表达,而抑制miR-192-5p则增加其表达(图5 D-P)。
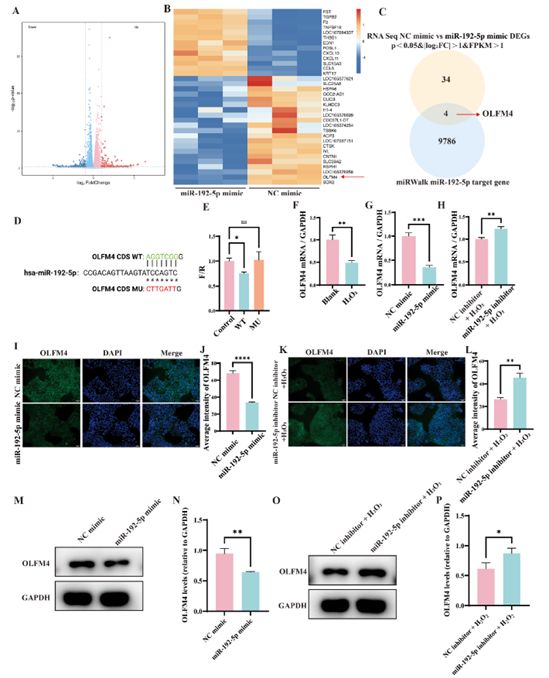
图5. miR-192-5p下游靶基因的筛选与验证
随后,挽救实验表明,OLFM4过表达可逆转miR-192-5p mimic对HaCaT细胞活力、迁移、凋亡及ROS生成的负面影响(图6)。
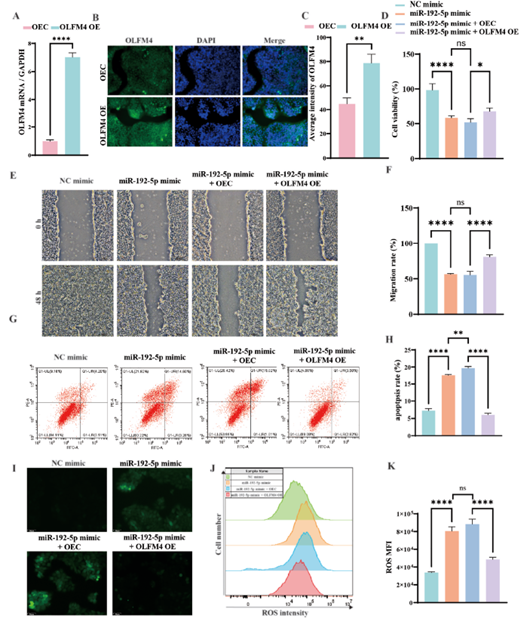
图6. 过表达OLFM4保护了HaCaT细胞免受miR-192-5p诱导的功能障碍
相反,在氧化应激条件下,敲低OLFM4会抵消miR-192-5p抑制剂的保护作用(图7)。
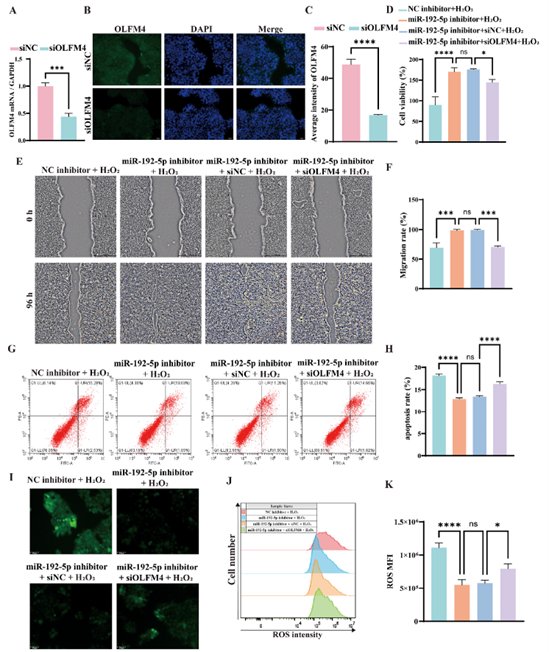
图7. 在氧化应激模型中,敲低OLFM4可逆转抑制miR-192-5p后对HaCaT细胞功能的保护作用
进一步的转录组分析和KEGG通路富集显示,OLFM4通过调控“细胞生长与死亡”相关通路来影响HaCaT细胞功能,包括上调BCL2、E2F2、CCNE1/2等基因的表达(图8)。这些结果为阐明OLFM4调控HaCaT细胞功能的机制提供了新的实验依据。
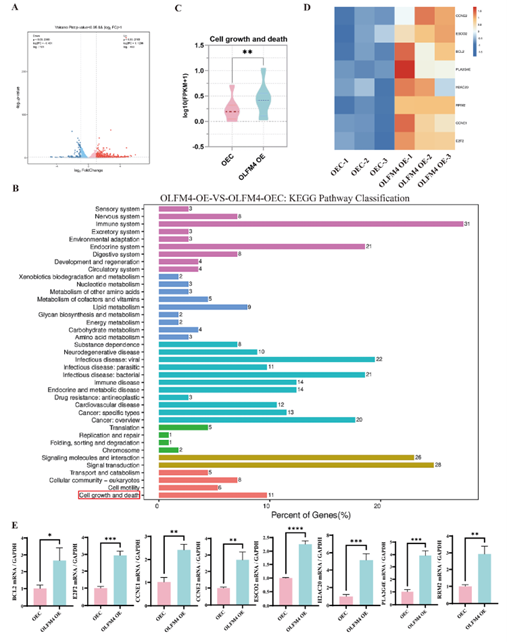
图8. 探究OLFM4影响HaCaT细胞增殖与凋亡的机制
5. antagomiR-192-5p工程化外泌体的制备与表征
接着,作者成功开发并表征了携带ant-192的工程化外泌体。通过透射电镜(TEM)观察到其具有典型的外泌体形态特征,纳米颗粒跟踪分析(NTA)检测显示其粒径分布符合天然外泌体特性,WB检测证实其表达外泌体标志蛋白CD81、HSP70和TSG101,而不表达阴性标志物Calnexin(图9 A-C)。荧光标记实验证明,这些工程化外泌体能够有效被HaCaT细胞内化,并将ant-192释放至细胞核周区域,载药效率达到35.22±0.34%(图9 D, E)。功能实验表明,与对照组ant-NC相比,负载ant-192的外泌体能够显著降低HaCaT细胞中miR-192-5p的表达水平,并在氧化应激条件下,有效增强细胞活力、促进细胞迁移并减少细胞凋亡,证实了该递送系统的治疗潜力(图9 F-K)。
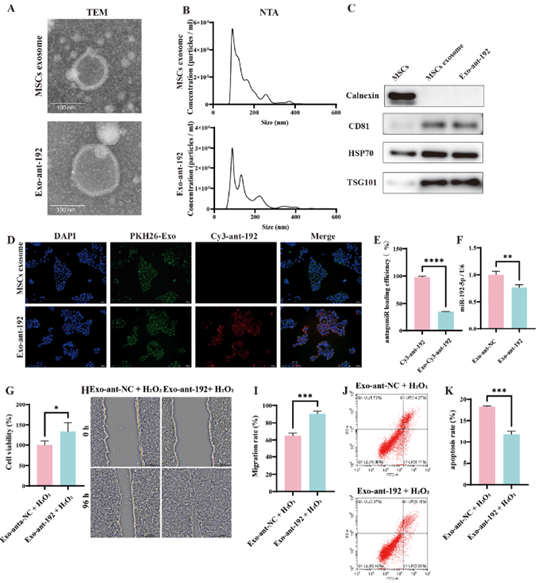
图9. miR-192-5p工程化外泌体的制备与表征
6. Exo@M-Gel水凝胶的制备与表征
作者还进一步成功制备了负载外泌体的MXene复合水凝胶(Exo@M-Gel),表征结果显示,光固化后的水凝胶具有良好的可注射性,且冻干后的Exo@Gel和Exo@M-Gel均具有疏松多孔的结构(图10 A-C)。CCK-8实验证实两种水凝胶均无细胞毒性,且降解速率相当,而Exo@M-Gel相较于Exo@Gel具有更缓释的外泌体释放特性和更优的压缩应力(图10 D-H)。此外,通过体外抗炎实验表明,Exo@M-Gel能显著降低LPS刺激的RAW264.7细胞中iNOS、IL-1β和TNFα的表达水平(图10 I-K)。
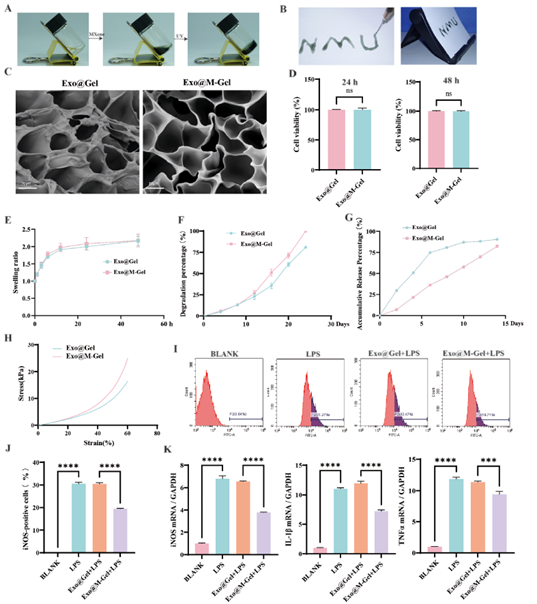
图10. Exo@M-Gel水凝胶的制备与表征
7. Exo-ant-192@M-Gel水凝胶保护表皮细胞功能并加速烧伤创面愈合
最后,作者探究了Exo-ant-192@M-Gel水凝胶在烧伤治疗中的效果,包括缓释性能和促进愈合的能力。通过体内荧光示踪结果显示,Exo-Cy3-ant-192@M-Gel组在第7天仍保持最强荧光信号,显著优于各对照组(图11 A)。表明其具有Cy3-ant-192持续释放的特性。另外,在小鼠烧伤模型中,Exo-ant-192@M-Gel治疗组表现出最优的创面修复效果:伤后第12天即实现约97.49%的创面愈合率,组织学检测显示完全上皮化,Ki67和CK14表达显著增加,提示创面表皮细胞增殖能力和细胞活性显著增强(图11 B-I)。以上结果表明,Exo-ant-192@M-Gel水凝胶系统对于烧伤治疗具有显著疗效,这为烧伤创面修复提供了新型的复合治疗策略。
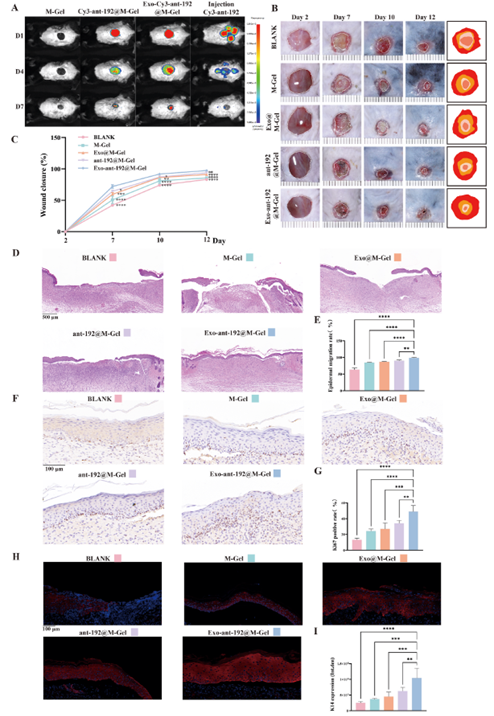
图11. Exo-ant-192@M-Gel持续释放ant-192并加速烧伤创面愈合
综上所述,本研究揭示了抑制miR-192-5p在烧伤创面愈合中的治疗潜力,通过创面边缘局部注射miR-192-5p抑制剂ant-192可显著加速伤口愈合过程,其作用机制主要是通过上调表皮细胞中的OLFM4表达,进而激活与细胞生长和死亡相关的下游通路,最终维持表皮细胞功能。研究团队还开发了一种具有缓释功能的Exo-ant-192@M-Gel水凝胶载药系统,该系统不仅能延缓ant-192的降解,还展现出抗炎特性。这一创新性给药平台为烧伤创面愈合提供了新的治疗策略。

查看更多

查看更多

查看更多

联系我们

返回顶部