查看更多

 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
细胞衰老是机体衰老及多种年龄相关疾病(如神经退行性疾病、骨关节炎等)的核心驱动力和关键治疗靶标。然而,其深层的分子调控机制,尤其是近年来备受关注的RNA表观遗传修饰——N6-甲基腺苷(m6A)在其中的作用,仍存在诸多争议。先前研究甚至得出关键的m6A去甲基化酶ALKBH5在衰老中作用相反的矛盾结论,暗示可能存在未知的复杂调控方式。同时,蛋白质异常聚集已被证实是衰老的典型特征,但ALKBH5是否会发生聚集并参与衰老进程,完全是一个未知领域。本研究首次揭示了ALKBH5通过胞质聚集介导m6A失衡并加速细胞衰老的新机制,不仅阐明了该蛋白相变在衰老进程中的关键作用,更为干预年龄相关疾病提供了通过m6A修饰RNA或强制核转位等创新治疗策略。

研究内容概述
2025年8月,广东省人民医院金国祥、香港大学李嘉诚医学院周中军、陆军军医大学卞修武作为共同通讯作者在《Cell Death & Differentiation》期刊发表了题为“Reversible ALKBH5 cytosolic aggregation accelerates cellular senescence”的研究论文。研究发现,ALKBH5在衰老过程中会从细胞核异常地定位于细胞质,并形成可逆的固样聚集。这一聚集现象阻碍了其正常的核功能,导致细胞内m6A分布失衡,并特异性地引起细胞周期蛋白CDK2的mRNA因过度甲基化而不稳定、加速降解,从而驱动衰老进程。衰老进程是由核孔蛋白Nup62的表达下降所触发,它本应协助ALKBH5以液滴相形式入核,而胞质m6A水平的下降又反过来加剧ALKBH5聚集,形成了一个恶性循环。本研究首次揭示了ALKBH5胞质聚集是连接m6A失衡与细胞衰老的关键桥梁,创新性地提出了通过补充m6A修饰RNA或利用核定位信号强制ALKBH5入核等策略,为干预衰老及相关疾病提供了极具潜力的新靶点与新方向。
在本研究中,汉恒生物有幸为作者提供了体内基因调控工具AAV9-ALKBH5、AAV9-NLS-ALKBH5、AAV9-NLS-ALKBH5mut以及AAV9-NES-ALKBH5。
下面,我们一起来了解具体的研究内容:
研究结果解读
1、ALKBH5细胞质滞留促进细胞衰老
基于对多种复制性衰老细胞及衰老组织的研究,作者发现ALKBH5在细胞衰老过程中呈现独特的亚细胞定位变化:其RNA水平虽未显著改变,但蛋白水平上升,并出现从细胞核向细胞质的明显转位。值得注意的是,抑制或敲低ALKBH5不仅未能缓解衰老,反而加剧衰老表型,提示其功能不依赖于简单的表达调控,而可能通过未知机制发挥作用。为了研究ALKBH5的定位再分布对细胞衰老的影响,作者进一步通过构建NLS(核定位信号)与NES(核输出信号)标记的ALKBH5进行功能验证,发现强制ALKBH5定位于细胞质(NES-ALKBH5)会显著促进衰老,而定位于细胞核(NLS-ALKBH5)则能有效挽救由ALKBH5缺失诱导的衰老表型。这些结果共同证实,ALKBH5的胞质滞留及其核转位障碍是促进细胞衰老的关键机制。
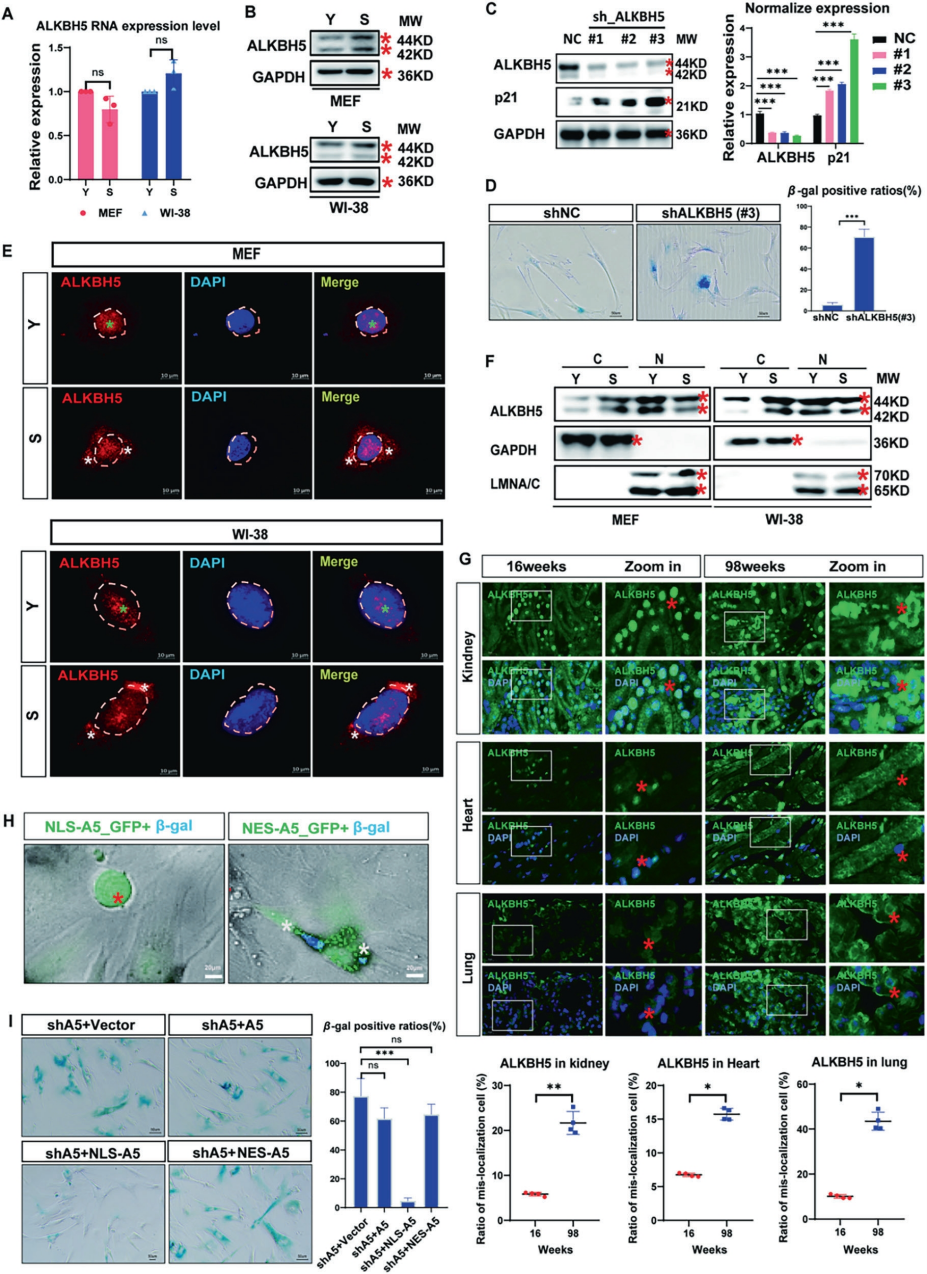
图1. ALKBH5胞质滞留促进细胞衰老
2、ALKBH5的胞质滞留通过破坏m6A稳态驱动细胞衰老
鉴于ALKBH5作为m6A去甲基酶的功能,作者推测其异常分布可能导致衰老细胞中m6A的失调。结果显示衰老细胞整体m6A水平显著下降,且呈现核内积累、胞质减少的空间分布失衡。通过转录组学筛选,鉴定出细胞周期调控关键基因Cdk2的mRNA在衰老过程中发生特异性m6A超甲基化,其修饰水平提升6-8倍。机制研究表明,Cdk2的高甲基化直接导致其mRNA稳定性下降、半衰期缩短,最终引起蛋白表达缺失。功能验证显示,敲低Cdk2可重现衰老表型,而强制表达核定位的ALKBH5(NLS-ALKBH5)不仅能有效逆转Cdk2的异常甲基化、延长其mRNA半衰期,更能显著缓解衰老进程。这些发现充分证明ALKBH5的胞质滞留通过破坏m6A稳态,特异性调控Cdk2等关键基因的RNA代谢,最终推动细胞衰老进程。
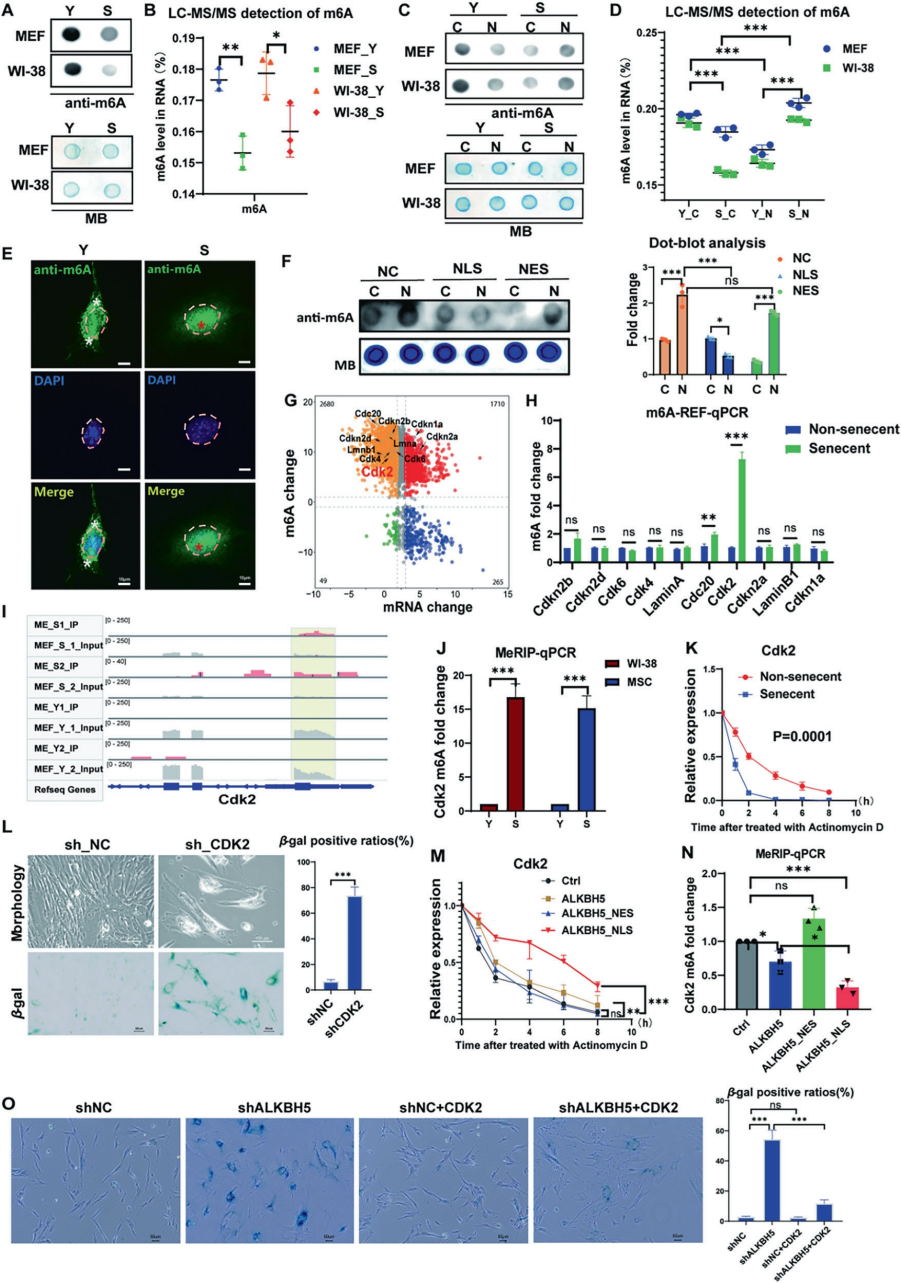
图2. ALKBH5的胞质滞留通过破坏m6A稳态驱动细胞衰老
3、m6A失衡反馈环路加剧ALKBH5胞质聚集
确定ALKBH5胞质滞留驱动细胞衰老的分子通路后,作者继续探索了细胞衰老过程中ALKBH5胞质滞留的潜在机制。实验发现衰老细胞中ALKBH5在胞质内与蛋白质聚集体共定位,并发生液固相变,形成不可逆的固样聚集。通过体外重构实验,证实ALKBH5的聚集状态受RNA底物m6A修饰调控:与非甲基化RNA结合诱导聚集,而与m6A修饰RNA结合则维持液相,且该过程具有可逆性。细胞水平实验进一步证明,导入非甲基化RNA探针可诱导ALKBH5胞质聚集并促进衰老标志物表达,而m6A修饰的RNA探针则能有效逆转衰老相关的ALKBH5聚集,缓解衰老表型。这些发现共同阐明了一个关键反馈环路:胞质m6A水平下降促使ALKBH5发生固相聚集,而其胞质滞留又进一步加剧m6A胞质/核内分布失衡,从而形成加速细胞衰老的自我强化机制。
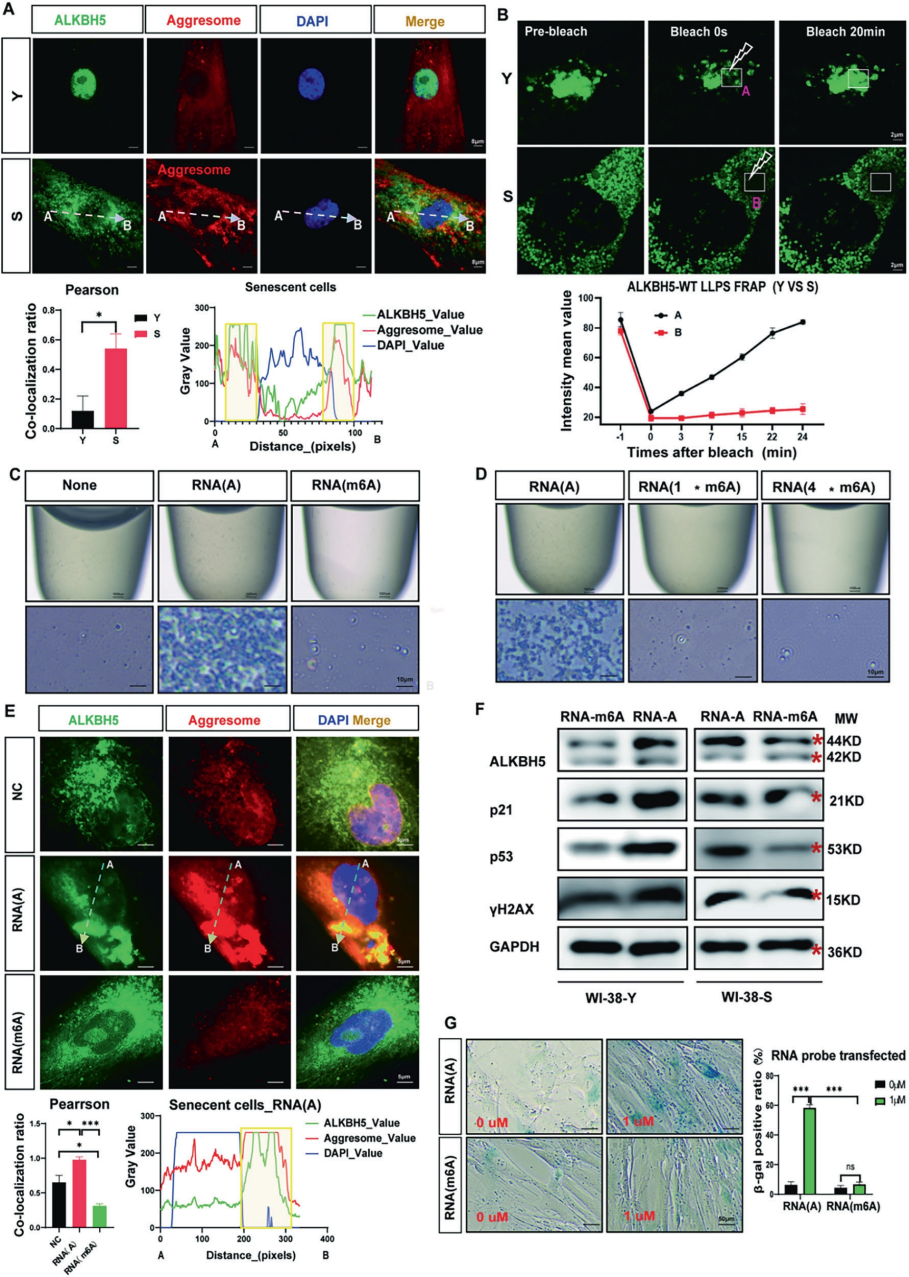
图3. m6A失衡反馈环路通过加剧ALKBH5胞质聚集加速细胞衰老
4、Nup62介导ALKBH5的核转位作用
为深入解析上述环路及衰老的启动机制,作者研究了ALKBH5的核运输机制。实验证实核孔复合体组分核孔蛋白p62(Nup62)通过其N端结构域与ALKBH5直接相互作用,形成稳定复合物,是介导ALKBH5核转位的关键因子。机制研究表明,Nup62表达下调会阻碍ALKBH5的正常入核,诱导细胞衰老表型。通过时序分析发现,在衰老进程中Nup62表达下降是最早的分子事件(P+4代),随后依次出现ALKBH5胞质滞留(P+5代)、m6A核质分布失衡(P+5至P+7代)和ALKBH5聚集(P+7代)。值得注意的是,强制表达核定位的ALKBH5可有效逆转Nup62缺失引发的衰老表型。这些发现揭示了完整的分子通路:Nup62表达下降→ALKBH5核转位受阻→胞质滞留→m6A失衡→ALKBH5聚集→细胞衰老。
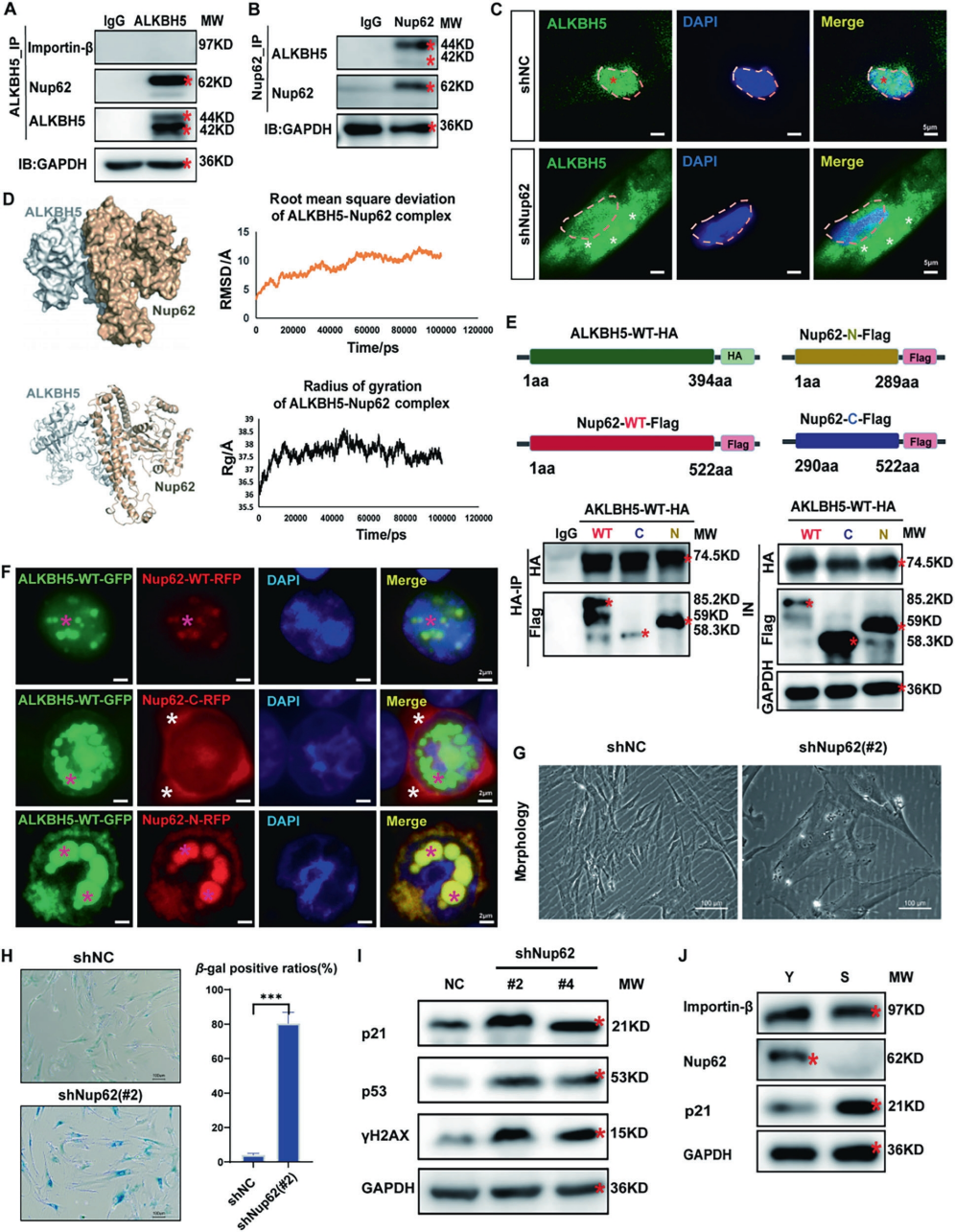
图4. Nup62是ALKBH5核转移的介质
5、ALKBH5固有结构调控其相变及亚细胞分布
为确定ALKBH5胞质聚集形成的关键蛋白结构域,作者使用天然无序区域预测器进行了相关分析。结果显示ALKBH5包含三个特征性结构域:N端无序区nIDR、中间催化结构域和C端无序区cIDR。通过构建系列截短体发现,各结构域呈现特异性相变特征:仅含nIDR的B截短体在核内呈扩散液相;含催化结构域和cIDR的C截短体在胞质形成固相纤维;仅含催化结构域的D截短体同样定位于胞质并形成固相结构;而仅含cIDR的E截短体则进入核内形成液滴相。荧光漂白恢复实验证实核内液滴具有典型液-液相分离特性,而胞质纤维结构则表现为不可逆的固相聚集。功能研究表明,仅含催化结构域的C/D截短体保留m6A去甲基化活性,而缺乏该结构域的B/E截短体则无此功能。这些发现提示ALKBH5通过其固有结构域组合调控形成“液相-固相-液滴相”三重相态,其中催化结构域是固相聚集与酶活性的共同基础,而两个无序区则共同决定了其核定位能力。
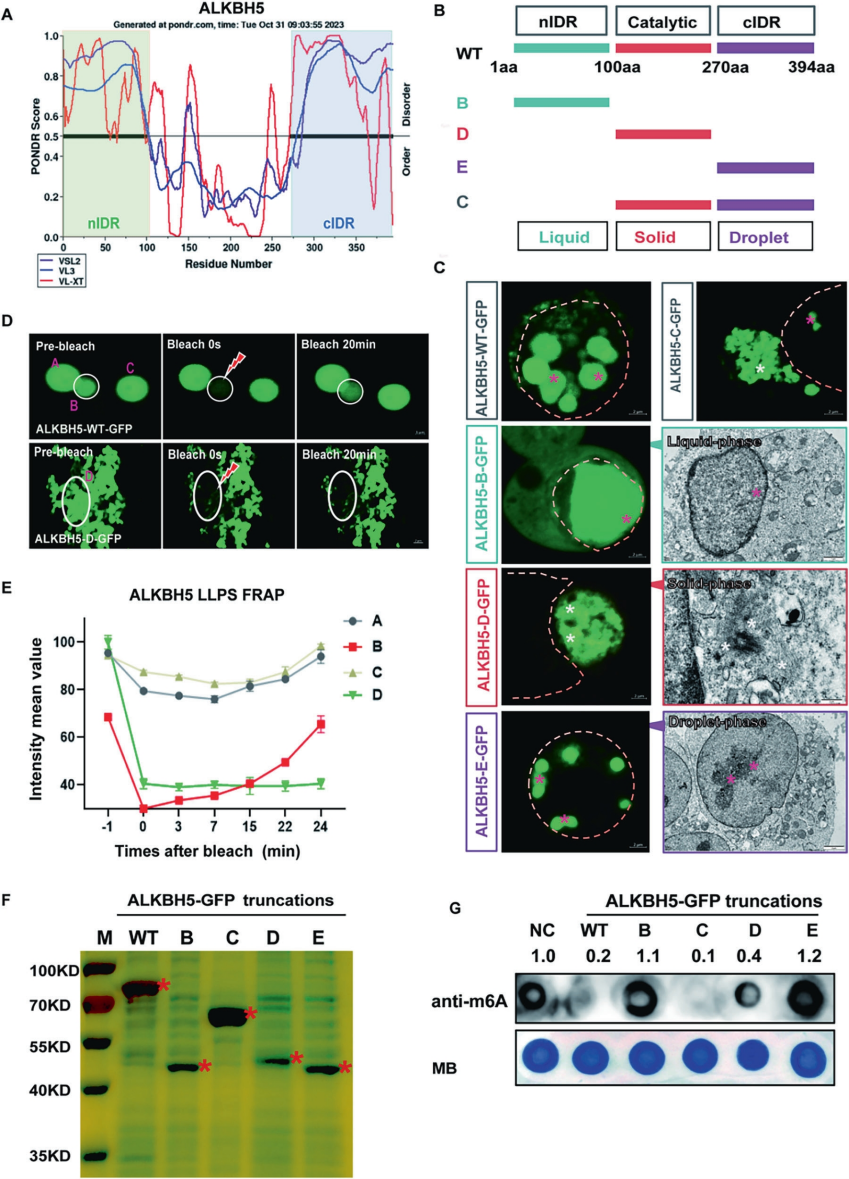
图5. ALKBH5固有结构调控其固相聚集转变与亚细胞分布
6、ALKBH5通过形成胞质液滴促进核运输
随后,作者探索了ALKBH5通过相变状态调控其核运输的精细机制。统计分析显示,ALKBH5的不同相态与其各截短体的细胞定位存在强相关性。通过活细胞成像首次观察到ALKBH5以液滴形式完成核输入的全过程,包括四个关键步骤:核周液滴形成、核膜结合、形变穿越及最终入核。值得注意的是,虽然固相截短体(C/D)能与核孔蛋白Nup62强烈相互作用,但这种结合反而导致两者共同滞留于细胞质;相反,液滴相截短体(E)则能与Nup62在核内成功共定位。这些发现共同证明ALKBH5的液滴相态是其通过Nup62介导实现有效核转位的先决条件,而固相聚集则会阻碍这一关键过程。
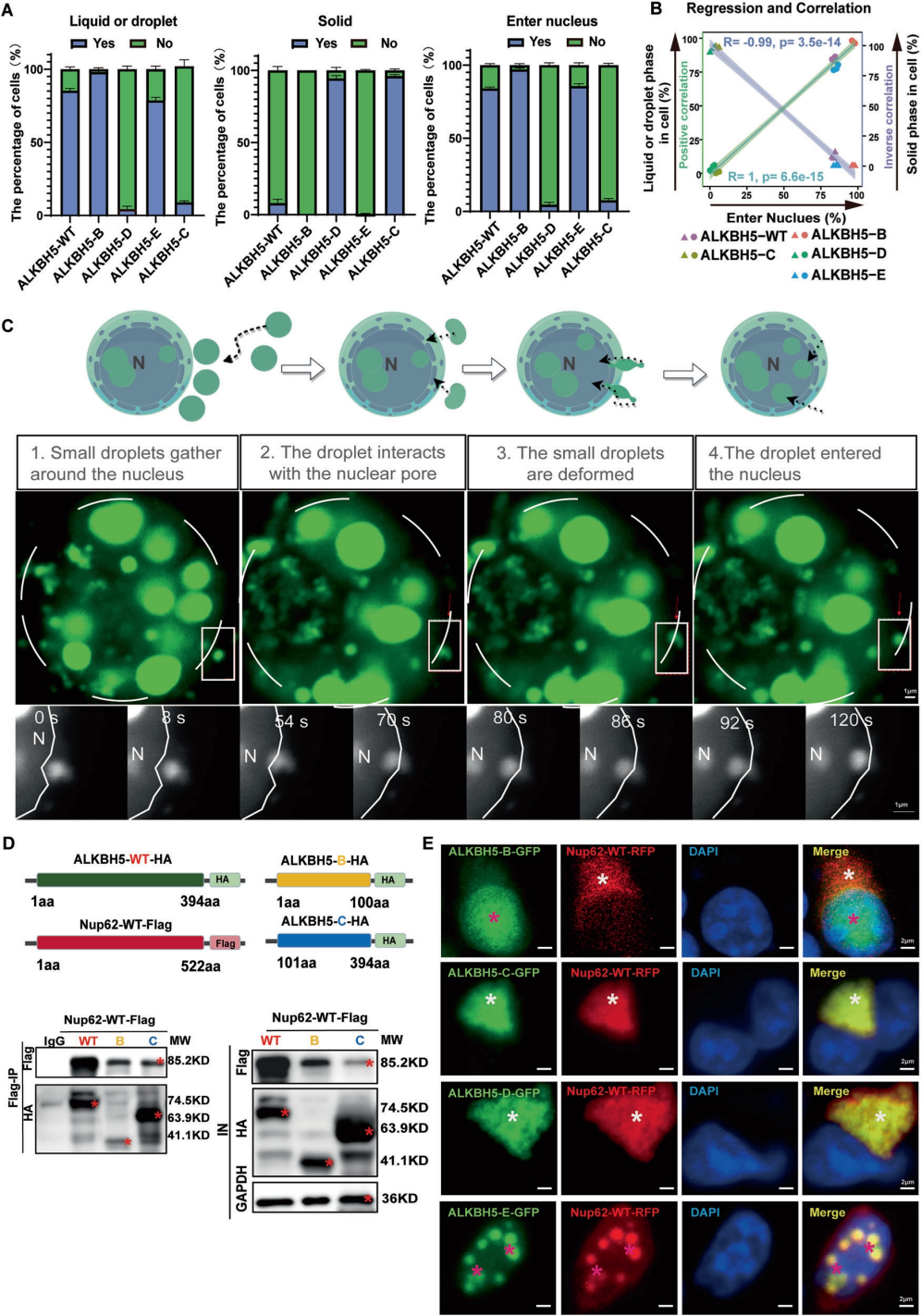
图6. ALKBH5通过形成胞质液滴促进核转运
7、NLS-ALKBH5在体内缓解衰老相关表征
在体外细胞中证实了NLS-ALKBH5能有效恢复核内m6A的稳态,挽救衰老表型。随后,作者使用AAV载体在衰老小鼠模型中进一步验证其可行性。结果显示,NLS-ALKBH5不仅能显著降低肾脏组织中p16阳性衰老细胞的数量,还能抑制p53、p21和γH2AX等关键衰老标志物的表达,同时恢复ALKBH5的正常核定位并减弱β-gal染色信号。值得注意的是,催化活性缺失突变体(NLS-ALKBH5mut)虽能正常入核却无法改善m6A水平或缓解衰老,证明NLS-ALKBH5的抗衰老作用严格依赖其m6A去甲基酶活性。这些发现不仅验证了ALKBH5核定位对延缓组织衰老的关键作用,更为靶向m6A调控的抗衰老治疗提供了直接证据。
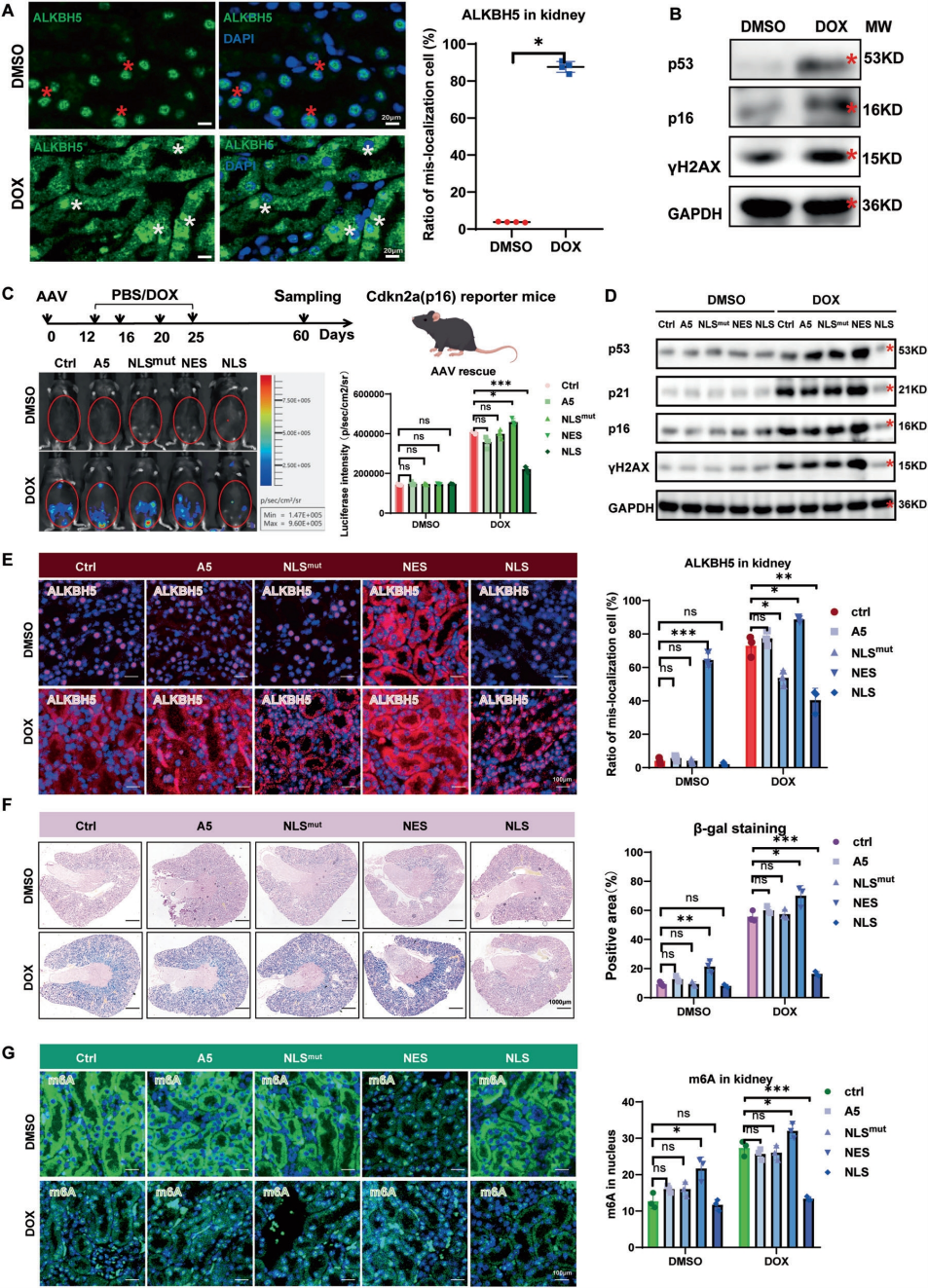
图7. NLS-ALKBH5缓解体内衰老相关特征
综上所述,本研究不仅揭示了ALKBH5胞质聚集是加速衰老的核心环节,还完整描绘了从Nup62下降到Cdk2甲基化异常失调的分子通路,更重要的是提出了可操作的干预策略,为开发延缓衰老和相关疾病的新型疗法奠定了坚实的理论基础。
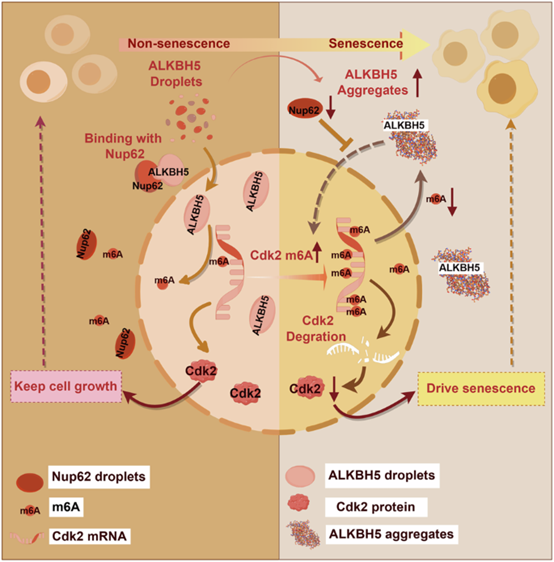
图形摘要. 可逆性ALKBH5胞质聚集加速细胞衰老

查看更多

查看更多

查看更多

联系我们

返回顶部