
 明星产品
明星产品
 干货推荐
干货推荐
 关注我们
关注我们

扫码关注我们
了解更多信息
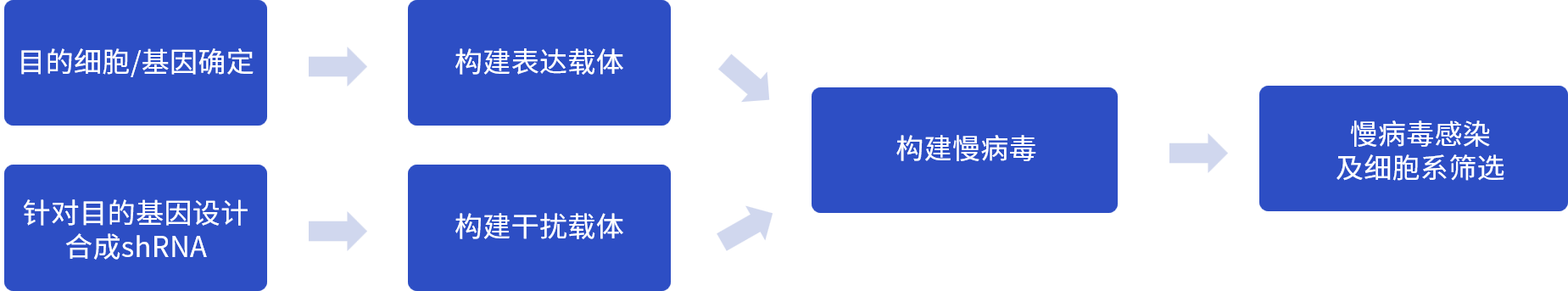
研究某个基因的功能最常用的手段是在宿主细胞中过表达或者通过RNA干扰的方法knock-down该基因,常规手段有瞬时转染和筛选稳定细胞系。
优势:筛选出该基因的过表达或者RNA干扰的稳定细胞系会给您的实验带来极大的便利。有了稳定细胞系,后期的Co-IP或者Pull-Down实验会非常便利;稳定表达重组荧光蛋白的细胞系可以让您动态地观察分子在细胞中的运动。
原理:构建稳定细胞系的基本原理是将外源DNA克隆到具有某种抗性的载体上,载体被转染到宿主细胞并整合到宿主染色体中,用载体中所含的抗性标志进行筛选。最常用的真核表达载体的抗性筛选标志物有新霉素(neomycin)、潮霉素(hygromycin)和嘌呤霉素(puromycin),常用G418来代替新霉素进行选择性筛选,筛选得到可稳定表达目的蛋白,或者稳定表达沉默特定基因的细胞株。
稳转和瞬转的区别
稳定转染:即进入细胞的质粒整合入细胞基因组中,并能随细胞分裂稳定传递下去。这是相对瞬时转染而言的。
瞬时转染:即外源基因不整合到宿主染色体中,表达时间短暂,绝大部分以游离形式存在,不能随细胞分裂而一同复制,导致最后拷贝数被稀释,无法达到持续表达外源基因的目的。一般用转染试剂进行质粒转染,多为瞬时转染。
一般如下情况需要构建稳定株
1、长期在目的细胞中研究基因功能,通过构建稳定株,可以降低频繁转染成本,方便实验研究;
2、部分蛋白半衰期极长,瞬时RNA只能干扰表达,无法去除已经表达的目的蛋白,通过构建稳定株可以实现更好的基因干扰效果;
3、瞬转往往会引入极高拷贝数的表达,导致因为人为因素造成实验结果的不精确,构建稳定株可以帮助筛选拷贝数适量的细胞进行实验研究;
4、需要用诱导表达系统的,主要是一些致死基因或者是需要时空表达的;
5、需要用细胞做动物实验的,比如裸鼠成瘤等.
质粒构建稳转细胞系
转染质粒后,单克隆方法筛选稳定细胞系。但质粒的整合效率低,一般不推荐
慢病毒构建稳转细胞系
慢病毒感染方法较质粒转染筛选单克隆方法更方便和高效,是目前主流的稳定细胞系筛选方法。
慢病毒几乎可以感染所有种类的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达,因此,慢病毒常用于制备稳定表达/沉默特定基因的单克隆细胞株circRNA /LncRNA过表达和干扰慢病毒。
汉恒生物构建包装的带puromycin抗性的慢病毒,在感染目的细胞后,可通过加入puromycin进行选择性筛选,从而获得稳定表达shRNA或者特定基因的细胞株。我们提供慢病毒包装服务(您可以自己完成稳态细胞筛选),或者一站式的稳定细胞系的筛选服务
我们一般将感染后经过筛选的细胞称为稳转株,也就是混合克隆细胞株。混合克隆细胞株虽然可以表达目的片段,但不同克隆(细胞)的目的基因整合位置和表达量均有所不同。
而单克隆细胞株是从混合克隆细胞中经单个细胞增殖所得,即由同一个细胞扩增得到的细胞株。每个细胞的目的基因整合位置以及表达量等特征均高度一致。
一般情况下,混合克隆稳转株即可满足科研需求,比如基因功能初步验证等实验,节省了单克隆化的时间与经济成本。但与单克隆株相比,以此得出的数据稳定性与重复性往往稍差,若想减少实验的波动,提高实验的可重复性,则需要挑选单克隆细胞株。例如细胞亚定位、药物靶点筛选或者难转染的细胞,推荐构建单克隆的稳定细胞株。

联系我们

返回顶部